用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑+ 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
(8分)从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
用MnO2,和浓HCl反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则(1)生成多少Cl2mol(2)可制得漂白粉多少克?
向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少
(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为mol/L。
(2)4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应: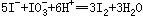 、
、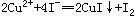 ,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定,
,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定, ,消耗了40 mL Na2S2O3溶液,计算:
,消耗了40 mL Na2S2O3溶液,计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,室温时Cu(IO3)2的溶解度是多少?
用a g氢气与b g氯气合成氯化氢气体,然后将反应后的气体用足量的氢氧化钠溶液充分吸收,试根据氢气、氯气体积比的不同情况讨论:
(1)吸收后剩余气体的质量。(2)吸收后生成食盐的质量。
将镁、铝的混合物0.1 mol溶于100 mL 2 mol/L的H2S04溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1="160" mL时,则金属粉末中,n(Mg) =()mol,V2=()mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13 +刚好沉淀完全,则滴入NaOH溶液的体积为多少
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑+ 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
计算题
取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·xH2O的摩尔质量(3)x值
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

①原合金中镁的质量为______________g
②铝的质量为___________________g
③盐酸的物质的量浓度为_____________mol/L
2.8g 铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。
求:
(1)产生的气体在标准状况下的体积。
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。
(3)稀硫酸的物质的量浓度。