12mL0.5mol L-1的Na2SO3恰好与l0mL0.2mol-L-1的K2R2O7溶液完全反应,则R元素在还原产物申的化合价为
A,+l B·十2 C.+3 D.+6
加热NH4HCO3固体,使产生的气体依次通过过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气
| A.O2 | B.NH3 | C.CO2 | D.CO2和O2 |
下列各组离子能在溶液中大量共存的是
| A.H+、Ba2+、NO3-、OH- | B.Mg2+、Na+、Cl-、OH- |
| C.Na+、H+、NO3-、CO32- | D.Cu2+、Fe3+、Cl-、SO42- |
下列离子在溶液中能大量共存的是
| A.Fe3+ NH4+ SCN-Cl- | B.Ba 2+H+ NO3-SO42- |
| C.Fe3+ Fe2+ Na+ NO3- | D.Fe2+ NH4+ Cl- OH- |
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是
| A.只用盐酸一种试剂就可以确定该固体M的具体成分 |
| B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 |
| C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 |
| D.用pH试纸检验,若pH=7,则固体M一定是Na2SO4 |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)
Z(g)+W(s)
ΔH>0,下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.升高温度,平衡逆向移动 |
| C.平衡后加入X,上述反应的ΔH增大 |
| D.当容器中气体压强不变时,反应达到平衡 |
在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
反应A(g)+3B(g) 2C(
2C( g) ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
g) ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
| A.正反应速率和逆反应速率减小,平衡向逆反应方向移动 |
| B.正反应速率和逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率加大,逆反应速率减小,平衡向正反应方向移动 |
| D.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是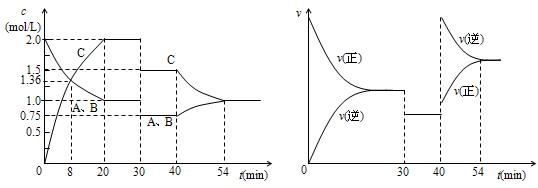
| A.30min时降低温度,40min时升高温度 |
| B.20min时A的平衡转化率比54min时大 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为4 |
环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是
| |
环境问题 |
造成环境问题的主要物质 |
| A |
酸雨 |
二氧化硫 |
 B B |
温室效应 |
二氧化碳 |
| C |
白色污染 |
二氧化硅 |
| D |
光化学烟雾 |
二氧化氮 |
根据元素的单质和化 合物性质判断元素非金属性强弱的依据是
合物性质判断元素非金属性强弱的依据是
①元素最高价氧化物的水化物的碱性强弱 ②元素最高 价氧化物的水化物的酸性强弱
价氧化物的水化物的酸性强弱
③元素单质跟酸反应置换出氢的难易 ④元素单质跟氢气生成气态氢化物的难易
| A.①②③④ | B.③④ | C.①②④ | D.②④ |