在氯化铵溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| D.c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
在pH=1的无色溶液中能大量共存的离子组是 ( )
| A.NH4+、Mg2+、SO42ˉ、Cl- | B.Ba2+、K+、OH-、NO3― |
| C.Al3+、Cu2+、SO42ˉ、Cl- | D.Na+、Ca2+、Cl-、AlO2― |
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
| A.Al3+ Na+NO3- Cl- | B.K+ Na+ Cl- NO3- |
| C.K+Na+Cl- AlO2- | D.K+ NH4+ SO42- NO3- |
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A.在标准状况下,以任意比例混合的CH4与CO2的混合物22.4L,所含有的分子数为NA |
| B.在标准状况下,NA 个H2O 分子所占体积为22.4L |
| C.常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA |
| D.常温常压下,28g氮气含有的核外电子数为10 NA |
在水电离出的C(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是( )
| A.K+、Na+、HCO3-、Cl- | B.K+、AlO2-、Br-、Cl- |
| C.Na+、Cl-、NO3-、SO42- | D.Al3+、NH4+、Cl-、SO42- |
加入铝粉产生氢气的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A.NH4+、NO3-、CO32-、Na+ | B.Na+、Ba2+、Mg2+、HCO3- |
| C.NO3-、Cu2+、K+、Cl- | D.NO3-、K+、AlO2-、OH- |
有200mLMgCl2 和AlCl3的混合溶液,其中c(Mg2+)= 0.2mol/L,c(Cl-)= 1.3mol/L,要使Mg2+全部转化为沉淀分离出来,至少需要4mol/LNaOH溶液的体积是( )
| A.40mL | B.72mL | C.80mL | D.128mL |
下列各组中的两种物质作用时,反应条件改变, 不会引起产物种类
变化的是( )
| A.Na和O2 | B.Ca(OH)2和CO2 |
C.Fe和HCl | D.C和O2 |
有一反应:2A+B 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )

A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
下列物质结构、性质的比较顺序正确的是:
| A.金属性:Mg>Al>Na>Ca |
| B.非金属性:F>O>S>P |
| C.碱性:KOH>NaOH>Al(OH)2>Ca(OH)2 |
| D.氢化物稳定性: HF>HCl>H2S>SiH4>PH3 |
在所给的四种溶液中,各种离子能在原溶液中大量共存并形成无色溶液的是( )
| A.在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合。则关于该物质的说法不正确的有( )
| A.该物质的化学式为C21H26O6 |
| B.该物质中含有1个手性碳原子 |
| C.1mol该物质最多能消耗5mol H2和含3mol NaOH的溶液反应 |
| D.该物质能发生加成反应、取代反应、氧化反应 |
物质的量浓度相等的氨水溶液与硫酸溶液等体积混合,则有关混合溶液中离子浓度关系不正确的是( )
| A.c(SO42-)>c(H+)>c(NH4+)>c(OH-) | B.c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
| C.c(OH-)-c(NH4+)=c(H+)-2c(SO42-) | D.c(OH-)+c(NH3·H2O)=c(H+)-c(SO42-) |
为提高中学生的公益意识,某市团委举办了一次科技下乡活动,在为农民伯伯做铅蓄电池的介绍时,下列分析属于失误的是(已知铅蓄电池的反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O)( )
2PbSO4+2H2O)( )
| A.铅蓄电池是生活里最常用的可充电电池,在充电时,电池的正极应接直流电源的正极 |
| B.铅蓄电池在放电时,电解液的酸性减弱 |
| C.铅蓄电池在放电时,PbO2作为负极,不断转化为PbSO4 |
| D.铅蓄电池在充电时,PbO2是氧化产物 |
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图一中t0~t1阶段c(B)未画出。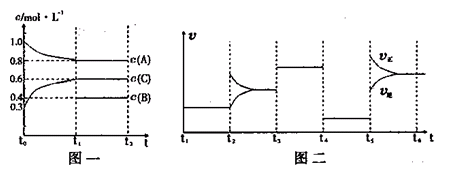
下列说法不正确的是( )
A.此温度下该反应的化学方程式2A(g)+B(g) 2C(g)
2C(g)
B.t4~t5阶段改变的条件为减小压强
C.B的起始物质的量为1.0mol
D.在相同条件下,若起始时容器中加入a mol A、bmol B和cmol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+ =2.4 和 b+
=2.4 和 b+ =1.2
=1.2