在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
| A.c(A-)=c(K+) | B.c(H+)=c(OH-)<c(K+)<c(A-) |
| C.V总≥20mL | D.V总≤20mL |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42-)>c(NH4+) >c(Cu2+)>c(H+)>c(OH-) |
| C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
分别将下列物质:①CuSO4 ② Na2SO3 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是( )
| A.①②③ | B.①③ | C.③④ | D.④ |
在pH=1的无色溶液中能大量共存的离子组是
| A.NH4+、Mg2+、SO42-、Cl- | B.Ba2+、K+、OH-、NO3- |
| C.Al3+、Cu2+、SO42-、Cl- | D.Na+、Ca2+、Cl-、HCO3- |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是
| A.H3O+、NO3-、Fe2+、Na+ | B.Ag+、NO3-、Cl-、K+ |
| C.K+、Ba2+、OH-、SO42- | D.Cu2+、NH4+、Br-、OH- |
下列离子方程式中正确的是
| A.硫化亚铁放入盐酸中 S2- + 2 H+ → H2S ↑ |
| B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S → CuS↓ + 2 H+ |
| C.氯化亚铁溶液中通入少量氯气 Fe2+ + Cl2 → Fe3+ + 2Cl- |
| D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- → CO32- + H2O |
下列反应的离子方程式错误的是
| A.向碳酸氢钙溶液中加人过量氢氧化钠 Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢按溶液混合 Ba2++2OH-+NH++HCO3-→BaCO3↓+NH3·H2O+H2O |
| C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+→Al3++3H2O |
| D.过量CO2通入氢氧化钠溶液中 CO2+2OH-→CO32-+H2O |
已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). Q>0.该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是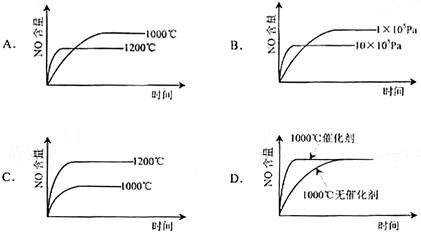
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)  Z(g)+W(s):Q<0下列叙述正确的是
Z(g)+W(s):Q<0下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 | D.平衡后加入X,上述反应放出的热量增大 |
在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是
| A.2Na +2H2O =" 2NaOH" + H2↑ |
| B.SO2+2H2S = 3S+2H2O |
| C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
| D.Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3·H2O+6H2O |
氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是
4NO(g)+6H2O(g) ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是
在粗制CuSO4·5H2O晶体中常含有杂质Fe2+,为了除去Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,再调节溶液的pH=4,过滤、蒸发、结晶即可。下列说法正确的是
| A.由题目可知,Cu2+可以大量存在于pH=4的溶液中 |
| B.可用浓硫酸代替H2O2 |
| C.未加H2O2前的硫酸铜溶液pH < 4 |
| D.调节溶液pH=4可选择的试剂是氢氧化铜或氨水 |
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸,曲线如右图所示,有关叙述错误的是
A.在A、B间任一点,溶液中都有c(Na+)>c(CH3COO-) > c(OH-)>c(H+)
B.在B点,a >12.5,且c(Na+)=c(CH3COO-)
C.在C点,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.在D点,c(CH3COO-)+c(CH3COOH)=0.2mol/L