有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
| 溶液 |
甲+乙[来 |
乙+丙 |
丙+丁 |
甲+丁 |
| 现象 |
无明显现象 |
白色沉淀 |
白色沉淀 |
无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是
A.HCl、BaCl2、H2SO4、Na2CO3
B.H2SO4、HCl、BaCl2、Na2CO3
C.HCl、H2SO4、BaCl2、Na2CO3
D.H2SO4、Na2CO3、HCl、BaCl2
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH |
HClO |
H2CO3 |
| Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.4×10-7 Ka2=4.7×10-11 |
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是

A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C.图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
| A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 |
| B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O |
| C.c点到d点的反应中共转移0.6mol电子 |
| D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O |
常温下,在20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示。下列说法正确的是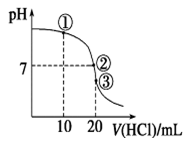
| A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.①、②、③三点所示的溶液中水的电离程度②>③>① |
| D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
| A.原溶液中一定含有Na2SO4 |
| B.反应最后形成的溶液中的溶质只有NaCl |
| C.原溶液中含有CO32- 与AlO2-的物质的量之比为1∶2 |
| D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2— |
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
| A.②③ | B.①③ | C.④⑤ | D.②④ |
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z都是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.如果X、Y都为非金属单质,则Z必为金属单质 |
| D.如果X、Y都为金属单质,则Z必为非金属单质 |
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是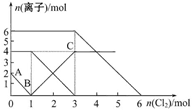
| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
某种溶液只含下表离子中的几种(不考虑水的电离与离子水解),且各种离子的物质的量浓度均为0.1 mol·L-1。
| 阳离子 |
K+ NH4+Fe2+Mg2+ Al3+Cu2+ |
| 阴离子 |
OH- Cl- AlO CO CO SO SO SiO SiO |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A.原溶液中只含有NH4+、Fe2+、Cl-、SO
B.由沉淀A推断原溶液中一定含有SO
C.滤液A中可能含有K+、Al3+、Cl-
D.沉淀B中一定含有Mg(OH)2
已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N |
| C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 |
| D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|||
| n(X) |
n(Y) |
n(M) |
||||
| ① |
700 |
0.40 |
0.10 |
0.090 |
||
| ② |
800 |
0.10 |
0.40 |
0.080 |
||
| ③ |
800 |
0.20 |
0.30 |
a |
||
| ④ |
900 |
0.10 |
0.15 |
b |
||
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
| A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL |
| B.当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) |
| C.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol |
| D.参加反应的金属的总质量一定是9.9g |
下列离子方程式书写正确的是


①向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
②向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
③向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O ④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
④向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
⑤向含0.5mol溴化亚铁溶液中通入0.5mol氯气2Fe2++Cl2=2Fe3++2Cl-
⑥澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3
⑦氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O
⑧小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O
| A.②④ | B.①⑥ | C.③⑤⑥ | D.①③⑦ |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |