常温下,下列溶液中各微粒的物质的量浓度关系正确的是( )
| A.浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) |
| B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| C.NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) |
| D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO) + c(ClO-)= c(HCO3-) + c(H2CO3) + c(CO32-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.c(H+)/ c(OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| C.由水电离的c(H+) = 1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- |
| D.含1.0mol·L-1Al3+的溶液中:Na+、HCO3﹣、SO42﹣、Mg2+ |
下列离子方程式中不正确的是 ( )
| A.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-=CaCO3↓+H2O |
| B.硫代硫酸钠与稀硫酸反应的离子方程式为S2O32-+2H+=SO42-+S↓+H2O |
C.利用水解原理制备纳米材料TiCl4+(2+n)H2O 4HCl+TiO2·nH2O↓ 4HCl+TiO2·nH2O↓ |
| D.向明矾溶液中滴加Ba(OH)2至SO42-恰好完全沉淀时 |
Al3+ +2SO42-+2Ba2+ +4OH-=AlO2-+2BaSO4↓+2H2O
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
| B.1 mol -CH3和1 mol OH- 都含有10 NA个电子 |
| C.标准状况下3.36 L CCl4含碳原子数为0.15NA |
| D.1mol Na完全反应生成Na2O2时失去NA个电子 |
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2 Fe(OH)3 +3 Cl2+10KOH 0~30℃ 2 K2FeO4+6KCl+8H2O,对于该反应,下列说法正确的是
| A.水是还原产物 | B.Fe(OH)3发生还原反应 |
| C.Cl2是氧化剂 | D.每生成1mol K2FeO4转移2mol电子 |
Cl2、SO2均能使品红溶液褪色,后者因为品红分子结构中的生色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
下列说法正确的是
| A.向品红溶液中同时通入Cl2、SO2,漂白效果会更好 |
| B.加热可判断品红褪色是通入SO2还是通入Cl2引起的 |
| C.“无色化合物”分子中,19个碳原子都可能处在同一平面上 |
| D.品红分子结构中,19个碳原子不可能处在同一平面上 |
尼群地平片可用于治疗高血压。它的主要成分的结构简式如右图所示。下列关于这种化合物的说法正确的是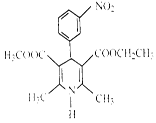
| A.该物质的分子式为C18H20N2O6 |
| B.该物质可以和银氨溶液发生银镜反应 |
| C.该物质属于芳香族化合物,能溶于水 |
| D.该物质在酸性条件下不发生水解反应 |
某羧酸的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜作催化剂和加热条件下氧化为E,其中D、E都不能发生银镜反应,由此判断A的可能结构简式有
A.2种 B.3种 C.4 种 D.6种
某二元酸(化学式H2B)在水中的电离方程式为H2B=H++HB-;HB- H++B2-,则在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-,则在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)=2c(B2-)+c(HB-)
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g) xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )

| A.P3<P4,y轴表示B的体积分数 |
| B.P3<P4,y轴表示混合气体的密度 |
| C.P3>P4,y轴表示B的百分含量 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A.标准状况下,22.4L乙醇的分子数为NA |
| B.1mol甲基中含有的电子数为10NA |
| C.13g乙炔和苯的混合气体中含有原子总数为2NA |
| D.1L 0.1mol·L-1乙酸溶液中H+数目为0.1NA |
往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为:
| A.(V2-V1)/V1 | B.V1 / V2 | C.V1 /(V2-V1) | D.V2 / V1 |
将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为5∶2,则原混合物中氧化铁与铁的物质的量之比为
| A.1∶1 | B.1∶2 | C.1∶3 | D.2∶5 |