下列说法正确的是
| A.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| B.若 2C(s)+O2(g)="2CO(g)" △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.右图可表示水分解过程中的能量变化 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(g)="2HCl" (g) △H=-a kJ/mol, |
Ⅱ:
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示。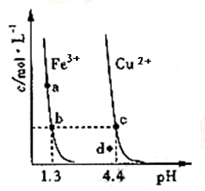
下列判断正确的是
| A.该温度下,Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B.c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等 |
| C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小 |
| D.加适量浓NH3·H2O可使溶液由a点变到b点 |
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g) 2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列说法中不正确的是
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列说法中不正确的是 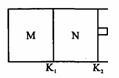
| A.反应达到平衡时N2的转化率:M<N |
| B.H2的体积分数:M<N |
| C.NH3的浓度:M<N |
| D.该反应在T℃时的平衡常数K:M=N |
中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。下列说法正确的是( )

A.B区的OH-通过隔膜向a电极移动,A区pH增大
B.图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C.c是正极,电极上的电极反应为:2H++2e-=H2↑
D.当有1mol电子转移时,b电极产生气体Y的体积为11.2L
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH减小2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
④pH=4、浓度均为0.1mol·L-1 的CH3COOH和CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
下列图示与对应的叙述相符的是( )

| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示常温下,0.100mol/LNaOH溶液滴定10.00mL、0.200mol/LHCl溶液所得到的滴定曲线 |
| C.图Ⅲ表示一定质量的冰醋酸加水稀释过程,醋酸溶液电离程度:c<a<b |
D.图Ⅳ表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g),在其他条件不变的情况下改变起始CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c>b>a N2(g)+4CO2(g),在其他条件不变的情况下改变起始CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c>b>a |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-离子中的几种。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )

| A.原溶液中一定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质仅为Na2SO4 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2 |
| B.通入SO2时,SO2与I2反应,I2作还原剂 |
| C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| D.滴加KI溶液,转移2 mol e-时生成1 mol白色沉淀 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中离子的说法不正确是( )
| A.至少存在4种离子 |
| B.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C.SO42-、NH4+一定存在 |
| D.CO32-、Al3+、K+一定不存在 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.0. 1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy |
| D.若8<a<10,则X、Y都是弱碱 |
液氨与水性质相似,也存在微弱的电离:2NH3 NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
| A.液氨的电离度 | B.液氨的离子积常数 |
| C.c(NH4+) | D.c(NH2-) |
用石墨作电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+ 的物质的量浓度为
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
已知某可逆反应:mA(g)+nB(g)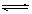 pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是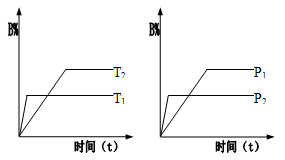
| A.T1<T2,P1>P2,m+n>p,△H>0 |
| B.T1>T2,P1<P2,m+n<p,△H>0 |
| C.T1>T2,P1<P2,m+n<p,△H<0 |
| D.T1>T2,P1>P2,m+n>p,△H<0 |