X,Y两元素为主族元素,它们可形成XY型的离子化合物,若Xm+和Ym-离子的核外电子数总和为20,则X、Y在周期表中的位置可以是( )
| A.X,Y在同一周期 |
| B.X,Y在同一主族 |
| C.相邻周期相隔一个主族的两短周期元素 |
| D.相邻周期相隔数个主族的短周期元素 |
下面叙述正确的是( )
| A.同族非金属元素,自上而下所形成的酸,其酸性渐弱,因为成酸元素的非金属性渐弱 |
| B.同族非金属的最低价阴离子,由上而下其还原性渐强,而氧化性渐弱 |
| C.同主族元素的单质,金属则越向下熔点基本上越低,非金属则越高 |
| D.元素周期表中Ⅲ B族的元素种类最多 |
下列各叙述中正确的是( )
| A.在氯化钠晶体中,每个Na+周围有6个Cl-,形成离子晶体 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子形成的网状结构,是典型的原子晶体 |
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
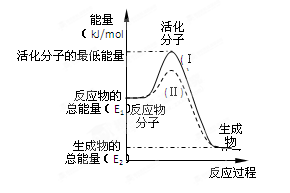
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+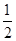 O2(g) = H2O(g) △H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) △H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
下列热化学方程式中的ΔH能表示物质燃烧热的是( )
| A.2 CO(g) + O2(g) =" 2" CO2(g) ΔH =" -" 566 KJ·mol-1 |
| B.CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH =" -" 890 KJ·mol-1 |
| C.2 H2(g) + O2(g) =" 2" H2O(l) ΔH =" -" 571.6 KJ·mol-1 |
| D.H2(g) + Cl2(g) =" 2" HCl(g) ΔH =" -" 184.6 KJ·mol-1 |
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是( )
| A.氯化钠 | B.生石灰 | C.氢氧化钠 | D.硝酸铵 |
用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
| |
阳极 |
阴极 |
溶液甲 |
物质乙 |
| A. |
Pt |
Pt |
NaOH |
NaOH固体 |
| B. |
Pt |
Pt |
H2SO4 |
H2O |
| C. |
C |
Fe |
NaCl |
盐酸 |
| D. |
粗铜 |
精铜 |
CuSO4 |
Cu(OH)2 |
下列说法正确的是( )
A.在101 k Pa时,1 mol C与适量 反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol 反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol |
B.在10l k Pa时,l mol 完全燃烧生成液态水,放出285.8 kJ热量, 完全燃烧生成液态水,放出285.8 kJ热量, 燃烧热为 —285.8KJ/mol 燃烧热为 —285.8KJ/mol |
| C.鉴定HCL和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
D.在稀溶液中: ,若将0.5mol ,若将0.5mol 的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ 的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
将含有0.400molCuSO4和0.200molKCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出19.2gCu,此时在另一电极上放出的气体在标准状况下的体积为( )
| A.5.60L | B.6.72L | C.4.48L | D.3.36L |
在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
| A.正极附近的SO42-离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
下列物质中与其它三组组成不同的是( )
| A.金刚石、石墨、C60 | B.红磷 、白磷 |
| C.氧气、臭氧 | D.一氧化碳、二氧化碳 |
下列离子方程式正确的是( )
| A.钠与水反应:2Na+2 H2O = 2Na+2OH-+H2↑ |
| B.氧化钠与盐酸:O2-+2H+ = H2O |
| C.碳酸氢钠与稀硫酸: CO32-+2H+=H2O+CO2↑ |
| D.烧碱溶液与碳酸氢钠溶液:HCO3-+OH-= H2O+CO2↑ |
欲除去NaHCO3溶液中少量的Na2CO3可加人( )
| A.饱和石灰水 | B.NaOH溶液 | C.盐酸 | D.通人CO2 |
下列关于NaHCO3的叙述,不正确的是( )
| A.它是一种白色粉末,溶解度小于Na2CO3 |
| B.加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 |
| C.与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 |
| D.它是一种碳酸盐 |
向 20mL 0.1mol/L的 Ca(OH)2溶液中通 CO2,若得到0.001mol沉淀,则通入CO2的物质的量可能是( )
| A.0.0015mol | B.0.002mol | C.0.003mol | D.0.004mol |