(12分)某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):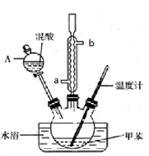
反应原理:
实验步骤:
①配制浓硫酸与浓硝酸(体积比按1:3)的混合物(即混酸)40 mL;
②在三颈瓶中加入15 mL甲苯;
③按图所示装好药品,并装好其他仪器;
④向三颈瓶里加入混酸,并不断搅拌(磁力搅拌器已略去);
⑤控制温度约为50℃,反应大约l0min,三颈瓶有大量淡黄色油状液体出现;
⑥分离出一硝基甲苯。
可能用到的有关数据如下:
| |
密度/g·cm-3 |
沸点/℃ |
溶解性 |
| 甲苯 |
0.866 |
110.6 |
不溶于水,易溶于硝基甲苯 |
| 产品1 |
1.286 |
237.7 |
不溶于水,易溶于液态烃 |
| 产品2 |
1.162 |
222 |
不溶于水,易溶于液态烃 |
请回答下列问题:
(1)配制40mL混酸的操作是 。
(2)冷却水应该从冷凝管 (填“a”或“b”)处流入。
(3)如果加热一段时间后发现装置漏气,应该采取的正确操作是 。
(4)分离产品的方案如下: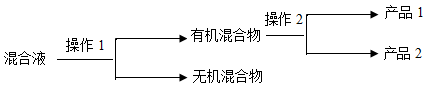
操作1的名称是 ;操作2必需的玻璃仪器共有 种。
(5)若最终得到产品1和产品2的总质量为17.42 g,则一硝基甲苯的总产率是 (保留到小数点后两位)。
现有一块铁碳合金,某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置进行实验(夹持仪器已省略),请你参与此项活动并回答相应的问题。

(1)以下有关合金的说法,正确的是 (填写字母)
A.铁碳合金的熔点高于纯铁和碳
B.铁碳合金的熔点介于纯铁和碳之间
C.铁碳合金的硬度大于纯铁
D.其他条件相同时,铁碳合金的耐腐蚀性强于纯铁
(2)按图示连接好装置,检验气密性,加入药品,称量F的质量,将m g合金样品放入A中,再通过B加入过量的浓硫酸。未点燃酒精灯前,A中无明显现象,其原因是: 。
(3)点燃酒精灯,反应一段时间后,C、D中可观察到明显的现象。写出合金样品在A中反应的化学方程式_______ , _________。
(4)C中的现象是____________________,D中足量酸性KMnO4溶液的作用是 。
硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
(2)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(3)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(反应方程式为:2Na2S+Na2CO3+4SO2 ==3Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:

请回答下列问题:
(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式______________________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经__________________(填写操作名称)、过滤、洗涤、干燥、得到产品。
(2)装置A用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____________________ 。
III.【测定产品纯度】
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O +2I-(忽略Na2SO3与I2反应)
+2I-(忽略Na2SO3与I2反应)
(4)滴定至终点时,溶液颜色的变化:_________________________________。
(5)滴定起始和终点的液面位置如图,则产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
IV.【探究与反思】
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,___________________ _,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。.
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是 。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置A中发生反应的化学方程式为 。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行: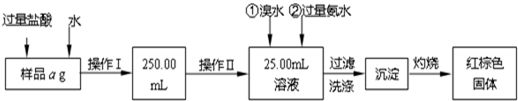
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式__________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是____________;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是_____。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么?
__________________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:__________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
Na2O2与水的反应实际是Na2O2 +2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g
②把这些过氧化钠固体放入气密性良好的气体发生装置中
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平
④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,若此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是 。

(4)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是 。
(5)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)。
如图1所示是实验室中制取气体的一种简易装置。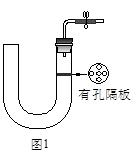
(1)请简述检验它的气密性的方法_______________________。
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)________________________气体。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。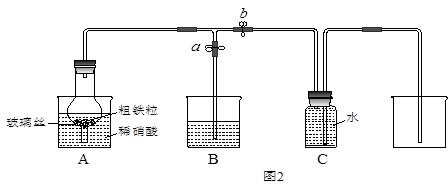
(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为____________(计算结果保留两位小数)。用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和 。
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是_______________________。B装置烧杯中液体的作用是__________________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 |
操作 |
现象与结论 |
| 第一步 |
取少量液体装于试管,向试 管中滴入几滴KSCN溶液。 |
|
| 第二步 |
|
若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
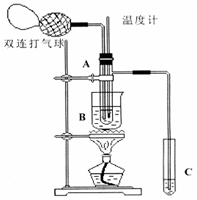
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
(1)用图所示装置制取Na2S2O3,其中NaOH溶液的作用是 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示剂,滴定终点的现象是 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的质量分数会 (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为: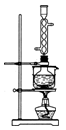
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
CoCl2•6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 、 。
(4)“操作1”中包含的基本实验操作,它们依次是 和过滤、减压烘干。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。.
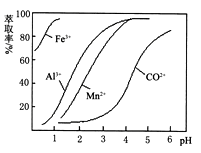
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)

(2)可能用到的有关数据列表如下
| 物质 |
熔点/℃ |
沸点/℃ |
密度(20 ℃) / g·cm-3 |
溶解性 |
| 苯 |
5.5 |
80 |
0.88 |
微溶于水 |
| 硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
| 1,3-二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
| 浓硝酸 |
 |
83 |
1.4 |
易溶于水 |
| 浓硫酸 |
 |
338 |
1.84 |
易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 。
(2)恒压滴液漏斗的优点是 。
(3)实验装置中长玻璃管可用 代替(填仪器名称)。
(4)反应结束后产品在液体的 层(填“上”或者“下”),分离混酸和产品的操作方法为 。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(6)为了得到更纯净的硝基苯,还须先向液体中加入 除去水,然后蒸馏,
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2 2KMnO4+MnO2↓+2K2CO3
2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度g/100g |
111 |
33.7 |
11.1 |
6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
加酸时不宜用硫酸的原因是: ;不宜用盐酸的原因是( )
(2)K2MnO4的转化2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(3)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知 涉及到的反应:Na2C2O4+ H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+ 2MnO4—+6H+→2Mn2++10CO2↑+ 8H2O
Ⅰ 称取0.80 g的高锰酸钾产品,配成50 mL溶液。
Ⅱ 称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为 (保留3位小数)。达到滴定终点的标志是 。
(4)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
(5)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,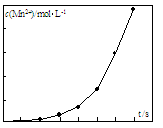
其原因可能为 。
(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
则依据表中数据,该NaOH溶液的物质的量浓度为 。
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度。用甲基橙作指示剂,下列操作可能使测定结果偏低的是__________。
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00 mL酸性高锰酸钾溶液应用 。(填仪器名称)
(4)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
Ag2CrO4 |
| 颜色 |
白 |
浅黄 |
砖红 |
滴定终点的现象是 。终点现象对应的离子反应方程式为 。
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,然后加150 mL蒸馏水并加入3 mL 0.5%淀粉溶液,用0.100 0 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为 。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O, I2+2S2O32-==2I-+S4O62-
②(NH4)2Cr2O7的摩尔质量为252g/moL)。
(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
为保护环境,节约资源,某研究性学习小组探究用易拽罐制取明矾[KAl(SO4)2·12H2O]。
查阅资料得知:明矾溶于水,不溶于乙醇:易拉罐主要成分为铝,另含有镁、铁等。
实验步骤如下:
步骤1、将易拉罐剪开,裁成铝片。用砂纸磨去表面的油漆,颜料及透明塑胶内衬:
步骤2、制备NaAlO2
称量1 g上述处理过的铝片,切碎,分数次放入盛有40mL5% NaOH溶液的烧杯中:将烧杯置于热水浴中加热。反应完毕后,溶液呈灰黑色浑浊,趁热过滤。
步骤3、氢氧化铝的生成和洗涤
在所得滤液中滴加3mol·L-1H2SO4溶液,用pH试纸检验,调节pH至8~9为止:此时溶液中生成大量的白色氢氧化铝沉淀,过滤,并用热蒸馏水多次洗涤沉淀
步骤4、明矾的制备
将过滤后所得氢氧化铝沉淀转入蒸发皿中,加10 mL 9mol/L H2SO4,再加15 mL水,小火加热使其溶解,加入4g硫酸钾继续加热至溶解,将所得溶液在空气中自然冷却,待结晶完全后,过滤,用无水酒精洗涤晶体两次;将晶体用滤纸吸干,制得明矾。
回答以下问题:
(1)步骤2中铝片溶于烧碱的反应建议在通风橱中进行,用热水浴加热,避免明火,原因是 ;过滤后,滤渣的主要成分是 。
(2)步骤3中,若调节pH过低,导致的结果是 ;洗涤氢氧化铝沉淀的方法是 。
(3)步骤4中用到的主要仪器是:铁架台(带铁圈),蒸发皿、量筒、漏斗、烧杯、酒精灯和 ;加入硫酸钾后制取明矾的化学反应方程式是 。
(4)不用水而用无水酒精洗涤明矾晶体的原因是 。
(5)实验验证明矾晶体中含有SO42—离子的方法是 。
(6)该实验制得明矾15.8 g,则称取的1 g铝片中铝元素含量不低于 %。