某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下:

该同学得出的结论正确的是( )
| A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素 |
| B.根据现象2可推出该固体粉末中一定含有NaNO2 |
| C.根据现象3可推出该固体粉末中一定含有Na2SO4 |
| D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
则依据表中数据,该NaOH溶液的物质的量浓度为 。
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度。用甲基橙作指示剂,下列操作可能使测定结果偏低的是__________。
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00 mL酸性高锰酸钾溶液应用 。(填仪器名称)
(4)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
Ag2CrO4 |
| 颜色 |
白 |
浅黄 |
砖红 |
滴定终点的现象是 。终点现象对应的离子反应方程式为 。
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,然后加150 mL蒸馏水并加入3 mL 0.5%淀粉溶液,用0.100 0 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为 。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O, I2+2S2O32-==2I-+S4O62-
②(NH4)2Cr2O7的摩尔质量为252g/moL)。
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42-)中提取铬。

有关数据如下表:
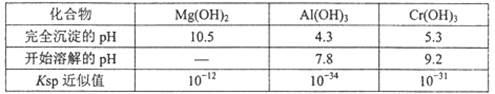
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4·7H2O,酸性工业废液中加入适量氧化铝的作用是 。
(2)若酸性废液中c(Mg2+)=0.lmol.L-l, 为达到步骤①的实验目的,则废液的pH应保持在 范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2的离子方程式为 。
(4)步骤④中反应的离子方程式为 。
(5)步骤⑤在空气中充分灼烧的目的是 ,可选用的装置是 (填序号)。
(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题。
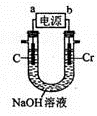
①a是电源的____极,阳极的电极反应式为________。
②若电解一段时间后阴极收集到标准状况下的气体3.36 L,则理论上可制得 g铬酸钠(忽略反应2CrO42-(aq) + 2H+(aq) Cr2O72-(aq)+ H2O(1)的影响)
Cr2O72-(aq)+ H2O(1)的影响)
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式___________________________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 _;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是____ _。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:____________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
| A.③②①⑤④ | B.③⑤②①④ | C.②③①④⑤ | D.①②③⑤④ |
I、如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:

(1)装置中仪器A的名称是 。
(2)请指出上图中的两处明显错误: 、 。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是 。
II、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 升华 C 结晶 D 分液 E 蒸馏 F 过滤
(1) 分离饱和食盐水与沙子的混合物;
(2) 从硝酸钾和氯化钠的混合液中获得硝酸钾;
(3) 分离水和汽油的混合物;
(4) 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
实验室里需要纯净的氯化钠溶液,但现只有含硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案提纯:

写出有关反应的化学方程式:
第①步
第②步
第③步
第④步 .
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:

①配制100mL 1.0mol•L﹣1的盐酸溶液;
②用 (填仪器名称并注明规格)量取7.5mL 1.0mol•L﹣1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为 g;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题.
(1)步骤①中,配制100mL 1.0mol•L﹣1的盐酸溶液时,下列哪些操作会使配制浓度偏小 (填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤② ,步骤③ g.
(3)实验步骤⑤中应选用 (填字母)的量筒.
A.100mL B.200mL C.500mL
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm= L/mol.
(5)若未除去镁条表面的氧化膜,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响).
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:

①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于"0"刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
④向锥形瓶中滴入几滴酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL;
⑤重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗稀硫酸为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)上述操作步骤中错误的一步是 (填步骤编号)。由此造成的测定结果 (填“偏高”、“偏低”或“无影响”)。
(4)某次滴定时的滴定管中的液面如图,则其读数为 mL。若记录读数时,起始时仰视,终点时俯视,则所测溶液浓度会 滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常,则所测溶液浓度会 (填“偏高”、“偏低”或“无影响”)。

(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.45 |
| 第二次 |
20.00 |
4.00 |
29.05 |
| 第三次 |
20.00 |
3.00 |
30.00 |
| 第四次 |
20.00 |
2.00 |
27.00 |
请计算待测烧碱溶液的浓度为 mol/L。
碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: 在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目
该反应中还原产物与氧化产物的物质的量比是__________,0.2mol KIO3参加反应时转移电子__________mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是________
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是 ,所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4 mL,配制中需要用到的主要玻璃仪器是(填序号) .
A 100mL量筒 B 托盘天平
C 玻璃棒 D 100mL容量瓶
E 50mL 量筒 F 胶头滴管 G 烧杯 H 500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是___________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾器名称为________________,确定反应达到终点的现象________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:_______________________。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
分某化学兴趣小组同学展开对漂白剂亚氯酸钠 (NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用图10所示装置进行实验。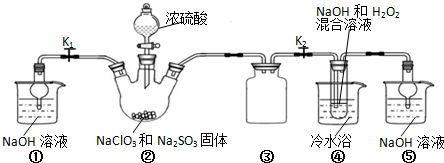
(1)装置③的作用是____________________。
(2)装置②中产生ClO2的化学方程式为_________________________;装置④中制备NaClO2的化学方程式为______________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③____________;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(4)达到滴定终点时的现象为___________________。
(5)该样品中NaClO2的质量分数为_______________(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________________。
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O;
3K2MnO4+ KCl+3H2O;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
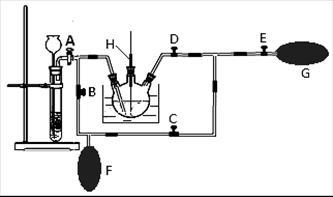
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是 。
(3)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将 。(填“偏大”、“偏小”、“不变”)
(共18分)(1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4·5H2O)为原料进行配制,请回答下列问题:
(i)完成下列步骤:
①用托盘天平称取胆矾 g。
②将称好的胆矾放入 中,加适量蒸馏水将其溶解,待 后将溶液沿玻璃棒转移入X容器中,X容器应为 。
③用少量蒸馏水洗涤溶解仪器2~3次,将洗涤液也注入X容器中,在操作过程中不能损失点滴液体,否则会使溶液的浓度 (偏高或偏低)。
④向X容器内加水至刻度线下 时,改用 小心地加水至液面与刻度线相切。若加水时仰视刻度线,会造成溶液浓度 (偏高或偏低)。
⑤最后盖好瓶塞,反复上下颠倒, 。
(ii)在X容器的使用方法中,下列操作不正确的是____________
A.X容器使用前需检验是否漏水
B.X容器用水洗净后,烘干后方可使用
C.若X容器洗净后未经干燥就直接使用,对溶液浓度无影响。
D.配制溶液时,把称好的固体用纸条小心倒入X容器中,加水溶解时需用玻璃棒引流。
(2)化学中很多时候需要对混合物进行分离和提纯,以下这套装置就常常用来分离液态混合物。
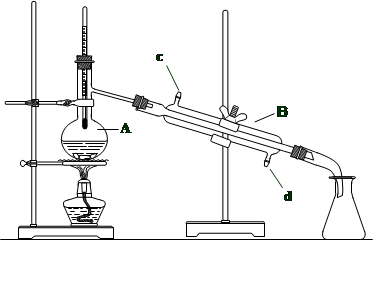
①利用这套装置来分离液态混合物的方法叫 。
②写出有关仪器的名称:A. B.
③图中有一处明显错误,请写出正确的做法: ,仪器B中的冷却水应该从 口(c或d)通入。
实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
| A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 |
| B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 |
| C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl |
| D.称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |