[化学——选修3: 物质结构与性质]Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度为 。
【化学—选修3物质结构与性质】(14分)
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1。
(1)Y与W所形成化合物晶体的晶胞如图所示。在1个晶胞中,W离子的数目为 。
(2)在Y与X形成的分子中,Y原子轨道的杂化类型是 。
(3)X与Y形成的气态物质在X与Z形成的气态物质中有很大的溶解度,其原因是存在氢键,若在两种氢化物的混合溶液中,再滴加少量的乙醇,则分子间存在 种不同类型的氢键。
(4)Y与Z可形成化合物Y2Z。
①请写出一种与Y2Z互为等电子体的分子的化学式 。
②请预测Y2Z分子的空间构型为 。
(5)Y与Z元素相比,基态原子的第一电离能谁大? (用元素名称回答)。
(6)X的氯化物与Y元素的气态氢化物的水溶液反应可形成配合物[W(YX3)4]Cl2,1 mol该配合物中含有σ键的数目为 个。
【化学—物质结构与性质】
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
| A.配位键 |
| B.极性键 |
| C.离子键 |
| D.非极性键 |
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,
其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。
(18 分)A、B、C、D、E、F 是周期表中的前20 号元素,原子序数逐渐增大。A 元素是宇宙中含量最丰富的元素,原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C 元素原子最外层p 能级比s 能级多1 个电子;D 原子p 轨道上成对电子数等于未成对电子数;E 的常见化合价为+3;F 最高正价与最低负价的代数和为4; G+的M 层电子全充满。用化学式或化学符号回答下列问题:
(1)G 的基态原子的外围电子排布式为 ,周期表中F 属于 区。
(2)B 与F 形成的一种非极性分子的电子式为 ;F 的一 种 具有较强还原性的氧化物分子的VSEPR 模型为
(3)BD2在高温高压下所形成的晶胞如图所示。
该晶体的类型属于_______(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C 元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3 种溶液:①pH=11 的甲的水溶液 ②pH=3 的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为 。
(5)丁、戊分别是E、F 两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4 混合后,溶液中各离子浓度大小顺序为 。
(6)A 和C 形成的某种氯化物CA2Cl 可作杀菌剂,其原理为CA2Cl 遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl 与水反应的化学方程式:___________________________
(7)往G 的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X 的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
( 在5-氨基四唑(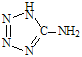 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ;
在1mol 5-氨基四唑中含有的σ键的数目为 。
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图示)顶点的氮原子,这种碳氮化钛化合物的化学式为 。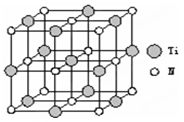
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 。(填写元素符号)
④[Ti(OH)2(H2O)4]2+中的化学键有 。
| A.σ键 | B.π键 | C.离子键 | D.配位键 |
【化学——选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_____________,该能层具有的原子轨道数为____________________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是__________________。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
汽车作为一种现代交通工具正在进入千家万户,汽车尾气的污染问题也成为当今社会急需解决的问题。为使汽车尾气达标排放,催化剂及载体的选择和改良是关键。目前我国研制的稀土催化剂催化转化汽车尾气示意图如图甲:
甲 乙
(1)下列有关说法正确的是________。
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.每个N2中,含有2个π键 |
| D.CO的一种等电子体为NO+,它的电子式为[:N⋮⋮O:]+ |
(2)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍为0价,镍原子在基态时,核外电子排布式为_____________________;[Ni(CO)4]的配体是________,配位原子是________。
(3)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是________。
(4)为了节省贵重金属并降低成本,也常用钙钛矿型复合氧化物催化剂。一种复合氧化物晶体结构如图乙,则与每个Sr2+紧邻的O2-有________个。
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构。
(1)有一种由铝、铜、铁三种元素构成的天然准晶体化合物,分析该准晶体组成的一种简单方法是先将该准晶体进行粉碎,然后按如下程序进行实验:
第1步:称取38.99 g 准晶体,让其与足量的NaOH溶液充分反应,在标准状况下,收集得到21.84 L 氢气。
第2步:将第1步反应后的浊液过滤出固体,用蒸馏水洗涤,逐滴滴入6mol/L盐酸,当加入的盐酸的体积为40mL时,固体不再溶解。
①铝、铁的第一电离能的大小关系为 (用元素符号表示)。
②根据以上实验可确定该准晶体的化学式为 。
(2)锰与一种短周期元素A形成的凝固态是一种准晶,已知A最外层电子数等于其电子层数,且其中含有成对和不成对电子。
①锰原子在基态时的核外电子排布式为 。
②锰与A在准晶体中的结合力为 。(离子键、共价键、金属键、分子间作用力)
③锰与A形成的准晶结构如图所示,则该准晶体的化学式为 。
④过渡金属配合物Mn2(CO)n的中心原子价电子数与配体提供电子总数之和为34,则n= 。
[化学——选修3:物质结构与性质](15分)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_____、电子数为____。
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C—C |
C—H |
C一O |
Si—Si |
Si—H |
Si一O |
| 键能/(kJ·mol-1) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________。Si与O的原子数之比为__________________。
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。
(1)M原子的外围电子排布式为_____________________,在周期表中属于 区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2·H2O和C、[M(H2O)4Cl2]Cl·2H2O。为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为_______________ (填A或B或C)。
(4) MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态MO2Cl2属于________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和________杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O42-互为等电子体的分子是(填化学式)__________。
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 。 
③如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。 
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如右图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示。请回答下列问题:
(1)E元素的电负性________M元素的电负性(填“>”、“<”或“=”)。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E-的最外层共有______种不同运动状态的电子,最外层电子分属______个能级。M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是_________分子(填“极性”或“非极性”)。
(4)M和G形成的一种化合物分子式为MG2,该分子的VSEPR模型为__________,分子的空间构形为___________。
(5)L的价电子排布式为_________,该元素位于周期表中_____族。
(6)R的化学式为________(用元素符号表示),属于_______晶体。已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a="_____________" cm,(阿伏加德罗常数用NA表示)。
有关元素的部分信息如下表所示:
| 元素 |
A |
B |
R |
D |
| 相应信息 |
短周期元素、最高正价为+7 |
基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 |
R核外电子共有15种运动状态 |
D与A能形成两种常见的化合物DA2,DA3 |
回答下列问题:
(1)D的基态原子电子排布式为 ,A、B、D三种元素电负性由大到小的顺序为 (用具体的元素符号填写)。
(2)化合物BA4、RA3、RA5中,中心原子的轨道类型不是sp3杂化的是 ,分子构型是正四面体的是 ,属于极性分子的是 (用化学式填写)。
(3)已知DA3的沸点:319℃,熔点:306℃,则DA3的晶体类型为 ,B与氢元素能形成BnH2n+2(n为正整数)的一系列物质,这一系列物质沸点的变化规律是 。
(4)R可形成H3RO4、HRO3、H3RO3等多种酸,则这三种酸酸性由强到弱的顺序为 (用化学式填写)。
(5)已知D的单质有如图所示的两种常见堆积方式:其中属于面心立方最密堆积的是 (填a或b);若单质D按b方式紧密堆积,原子半径为r cm,NA表示阿伏加德罗常数的值,则单质D的密度 g/cm3(列出算式即可)。
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
【化学—选修3:物质结构与性质】
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。