(12分)A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
(1)写出B的基态原子的核外电子排布式: 。
(2)A、C形成的分子极易溶于水,其主要原因是 。与该分子互为等电子体的阳离子为 。
(3)比较E、F的第一电离能:E F。(选填“>”或“<”)
(4)BD2在高温高压下所形成的晶胞如图所示 。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。
。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。
(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在 。(填序号)
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
【化学—--选修3:物质结构与性质】
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到下的顺序为 (用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 ,B元素与D元素形成分子空间构型为 ;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是______________________________________;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为________________;
(5)C晶体的堆积方式如图所示,
设C原子半径为r,晶胞中C原子的配位数为_______,晶胞的空间利用率为 。
【化学—物质结构与性质】
科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周期VIB族。
(1)晶体硅中硅原子的轨道杂化类型为______。
(2)电负性:C______S(填“>”或“<”)。
(3)晶体硅和C60比较,熔点较高的是______。
(4)Mo元素基态原子的价电子排布式为____________。
(5)根据MoS2的晶体结构回答:
①每个Mo原子周围距离最近的S原子数目为______。
②Mo-S之间的化学键为______(填序号)。
A极性键 B非极性键 C配位键 D金属键 E范德华力
③MoS2纳米粒子具有优异的润滑性能,其原因是______。
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子。
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。
当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 。
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如图。

(1)柠檬酸的晶体类型为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为 (填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。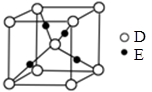
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
则该化合物的化学式是 。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z的一种核素的中子数为12,质量数为23 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第____周期第____族,
基态W2+的核外电子排布式为 。
(2)X的电负性比Y的____________(填“大”或“小”);X 和Y形成的XY32-离子中,中心原子的杂化类型是___________,其离子的空间构型为为 。
(3)写出Z2Y2的电子式 ,指出其中含有的化学键 ;XY2形成的晶体类型为 。
(化学---选修物质结构与性质)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 .(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(12 分)X、Y、Z、W、Q五种元素其核电荷数依次增大。X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子。
(1)Q2+离子的核外电子排布式为 。
(2)XYZ分子中Y原子轨道的杂化类型为 ,
1molXYZ分子中含有σ键的数目为 。
(3)写出YZW-离子的两种等电子体的化学式: 。
(4)QW的熔点比Q的硫化物的熔点高,其原因是
。
(5)Q晶体属于六方堆积,其晶胞结构见下图,则P点原子
被 个晶胞所共用。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni原子的价层电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为 。
丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题:
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为: > (用元素符号表示)。试解释其因: 。
(3)任写一种与AB_离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,∠EDE= ;E的配位数是 ;已知晶体的密度为 g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用 、NA的计算式表示)
、NA的计算式表示)
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。
(1)A原子核外共有________种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的原子核外电子排布式______________________;
(3)解释上表中氟化物熔点差异的原因:__________________________;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是________(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为___________(填离子符号)。
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molNO2+所含 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。

则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。