[陕西]2014届陕西省宝鸡市高三质检(一)理综化学试卷
化学与生活联系紧密,下列说法正确的是( )
| A.废弃的金属、纸制品、塑料、玻璃均是可回收资源 |
| B.酒精可用来消毒是由于其具有强氧化性 |
| C.PM 2.5是指大气中直径接近于2.5×10-6m的细颗粒物,这些细颗粒物分散在空气中形成的混合物具有丁达尔效应 |
| D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A.1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA |
| B.0℃、1个标准大气压下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
| C.含4mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| D.将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
下列离子方程式的书写及评价均合理的是( )
| 选项 |
离子方程式 |
评价 |
| A |
将2molCl2通入到含1molFeI2的溶液中: ,2Fe2++2I—+2Cl2 = 2Fe3++4Cl-+I2, |
正确;Cl2过量,可将Fe2+ 、I—均氧化 |
| B |
Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++ HCO3—+ OH—=" " MgCO3↓+ H2O |
正确;酸式盐与碱反应生成正盐和水 |
| C |
过量SO2通入到NaClO溶液中: SO2 + H2O + ClO- = HClO+HSO3- |
正确; 说明酸性: H2SO3强于HClO |
| D |
1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ 3H2O |
正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为:2Li+P2VP·nI2 = P2VP·(n-1)I2 +2LiI,则下列说法正确的( )
| A.该电池的电势低,使用寿命比较短 |
| B.电池工作时,碘离子移向P2VP一极 |
| C.聚2-乙烯吡啶的复合物与有机物性质相似,因此不会导电 |
| D.正极的反应为:P2VP·nI2 + 2Li+ + 2e- = P2VP·(n-1)I2 + 2LiI |
X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子最外层电子数之和为16,X与
其它元素不在同一周期和同一主族,Y的阴离子与Z的阳离子具有相同的电子层结构,W原子得到一个电子后可形成与某稀有气体原子核外电子排布相同的稳定结构。下列说法合理的是 ( )
| A.简单离子半径:W>Z>Y |
| B.X与Y形成的化合物中,既含极性键又含非极性键的物质至少有2种 |
| C.Z与W形成的化合物一定是离子化合物 |
| D.Y的最高价氧化物对应的水化物的酸性一定比W的弱 |
若不考虑立体异构,则分子式为C5H10O2且为酯的同分异构体共( )
| A.7种 | B.8种 | C.9种 | D.10种 |
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= 。
②T1 T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-)之比为 。
②该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-) ,c(Na+) 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示)。
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A装置可以重复使用。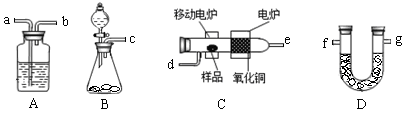
请回答下列问题:
(1)请按气体流向连接实验装置 → → →d→ → → → g(用仪器接口编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。 (4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
实验一:X在一定条件下可催化氧化最终生成有机物Y.
实验二:X与Y在浓硫酸加热条件下生成有机物Z.
则①写出实验二中反应的化学方程式 。
②除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
(4)还原炉中发生的化学反应为: 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题:
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为: > (用元素符号表示)。试解释其因: 。
(3)任写一种与AB_离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,∠EDE= ;E的配位数是 ;已知晶体的密度为 g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用 、NA的计算式表示)
、NA的计算式表示)
制备液晶材料时经常用到有机物Ⅰ,Ⅰ可以用E和H在一定条件下合成:
请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B按系统命名法名称为: 。
(2)芳香族化合物F的分子式为C7H8O, 苯环上的一氯代物只有两种,则F的结构简式为: 。
(3)C→D的反应条件为: 。
(4)A→B、G→H的反应类型为 、 。
(5)D生成E的化学方程式为 。
E与H反应生成I的方程式为 。
(6)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有 种(不考虑立体异构)。
试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号