(14分)环己酮是重要化工原料,可用于制造尼龙、己二酸等产品。可以尝试用次氯酸钠氧化环己醇制环己酮:



(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为 。
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35 ℃,除了用冰水浴冷却外,采取的措施还可能有____,并应在三颈瓶的A端口处应补加 (仪器名称)。
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为 。
(4)为将溶液的pH调至中性,可以加入的试剂是 。
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率 。
(12分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。请回答下列问题:
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为 ;冷凝水流经冷凝管时应从 口进入(填“a”或“b”);
(2)生成乙酸乙酯的化学反应方程式为 ;
(3)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(4)实验所得乙酸乙酯远低于理论产量的可能原因 。(写出其中两种)
(5)为了除去粗产品其中的醋酸,可向产品中加入 溶液,在分液漏斗中充分振荡,然后静置,待分层后 (填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(6)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是 。
(7)最后,加入干燥剂除去其中的水分,再进行 (填操作),即可得到纯净的乙酸乙酯。
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
| |
相对分子质量 |
沸点/℃ |
密度/(g/cm3) |
水中的溶解性 |
| 正丁醇 |
74 |
117.2 |
0.8109 |
微溶 |
| 正丁醚 |
130 |
142.0 |
0.7704 |
几乎不溶 |

①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应 (填“上”或“下”)口倒出。
(4)步骤③中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 (精确到1%)。
(14分) 三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
Ⅰ.在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是 。
A.反应后溶液中含有 |
B.反应后溶液中C( )增大 )增大 |
| C.实验过程中有化合反应发生 |
D.实验过程中 的电离程度不可能发生变化 的电离程度不可能发生变化 |
Ⅱ.有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按如表所示的量和反应条件在三颈瓶中加入一定量 ,再注入95%的乙醇,并加热,观察现象。
,再注入95%的乙醇,并加热,观察现象。
| 实验 |
 |
95%乙醇量/mL |
加热方式 |
| 实验1 |
2 |
4 |
酒精灯 |
| 实验2 |
2 |
4 |
水浴70 |
实验结果如下:
| 实验 |
实验现象 |
||
| 三颈瓶 |
收集瓶 |
试管 |
|
| 实验1 |
酒精加入时,立刻产生白雾,当用酒精灯加热时,有气泡产生,并逐渐沸腾,生成黏稠状液体 |
有无色液体 |
溶液褪色 |
| 实验2 |
酒精加入时,立刻产生白雾,当用水浴加热时,不产生气泡,一段时间后,反应瓶内生成黏稠状液体 |
有无色液体 |
溶液不褪色 |

根据上述材料,完成下列填空。
(1)写出实验室用乙醇制乙烯的化学方程式: 。
(2)上图装置中冷凝管的作用是 ,进水口为 (填“a”或“b”),浓硫酸的作用是 。
(3)实验1使溴的四氯化碳溶液褪色的物质是 。
(4)实验2中,水浴加热所需仪器有 (加热、夹持仪器,石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式: 。
(6)根据实验1、2可以推断:
①以 作为催化剂获得乙烯的反应条件是 。
作为催化剂获得乙烯的反应条件是 。
② 与95%乙醇在水浴70℃加热条件下可以发生的有机反应的类型是 反应。
与95%乙醇在水浴70℃加热条件下可以发生的有机反应的类型是 反应。
(16分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为 ;

(2)生成乙酸乙酯的化学反应方程式为 ;浓硫酸的作用是 ;
(3)冷凝水流经冷凝管时应从 口进入(填“a”或“b”);
(4)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(5)实验所得乙酸乙酯远低于理论产量的可能原因 。(写出其中两种)
(6)为了除去粗产品其中的醋酸,可向产品中加入 溶液,在分液漏斗中充分振荡, 然后静置,待分层后 (填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(7)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是 。
(8)最后,加入干燥剂除去其中的水分,再进行 (填操作),即可得到纯净的乙酸乙酯。
某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质。
(1)为迅速得到平稳的乙醇气流,可对装置A采用的措施是 。
(2)B中的现象为 。
(3)若装置C中开始发生倒吸,则采取的应急措施是______(填编号)。
a.移去图中的酒精灯 b.将C中的橡皮塞拔出 c.将B尾端的乳胶管取下 d.以上都可以
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因。
①假设。请写出假设2的化学方程式。
假设1:CH3CHO+Br2→CH2BrCHO+HBr ;
假设2: ;(加成反应)
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr。
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01 mol,则证明假设 正确。若溴水的体积为10.0 mL(设反应前后体积不变),近似计算反应后C中溶液的pH≈ 。
(5)按下图方案精制含有乙醇和水的乙醛,其中试剂为 ,操作名称为 。
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是 ;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。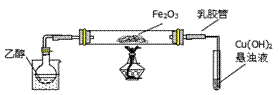
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是 ;
关于M中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下: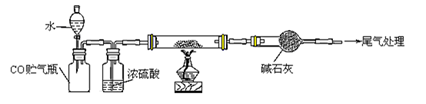
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中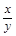 = 。
= 。
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)2悬浊液反应生成Cu2O。(代表酒精灯)
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 __(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是 _(填化学式)。该液体还可以与酸性KMnO4溶液反应产生相同的气体,写出该反应的离子方程式 。
(3)F装置中的固体试剂是 ,发生反应的化学方程式为 。反应一段时间后移去酒精灯,反应能继续进行,其原因是 。
(4)A装置和D装置中的实验现象分别为 、 。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见 。
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)气密性检验的操作过程是_________________________________________________________。
(2)为快速得到乙醇气体,可采取的方法是__________________________;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是_________(填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有铁离子和亚铁离子,检验该溶液中的亚铁离子的方法是_________;
关于M 中铁元素价态的判断正确的是____(填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3价,0价和+2价铁至少有一种
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取agM样品进行定量测定,实验装置和步骤如下:
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧
c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小bg,则FeXOY中 =_____。
=_____。
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管。请填写下列空白: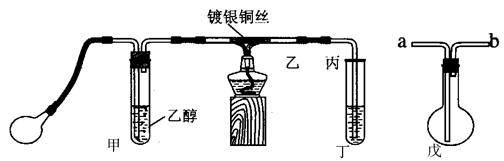
(1)甲装置常常浸在温度为70~80℃的水浴中,目的是________________________。
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
(3)乙醇的催化氧化反应是 反应(填“放热”或“吸热”),该反应的化学方程式为 。
(4)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是 ,
②若鼓气速度过快反应会停止,原因: ,
③若鼓气速度过慢反应也会停止,原因: 。
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_____________、______________接丙。