l,2一二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm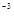 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2一二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2一二溴乙烷。
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。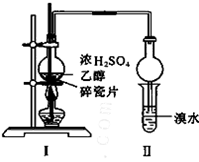
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由是___________。
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是_______________。
(4)丙同学对上述实验进行了改进,只通过观察溴水褪色即可证明乙烯的不饱和性,在I和II之间增加如图所示的装置,则A中的试剂为_______,其作用是__________________B中的试剂为___________,其作用是___________________________。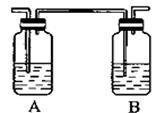
(5)丁同学通过洗涤、蒸馏等操作对装置II中的l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________
某研究性学习小组的同学利用下列装置进行乙醇催化氧化的实验。请分析回答:
(1)请写出实验过程中的总的化学反应方程式__________________________。
(2)在不断鼓入空气的情况下,移去酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应。进一步研究表明,鼓气速度与反应体系的温度关系曲线如右图所示。鼓气速度过快,反应体系温度反而下降的原因___________________________。
(3)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是_________________________。
(4)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是_______________。
(5)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:
①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?_______________________。
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应: 。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题:
。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题:
(1)写出装置A中制备乙烯的化学方程式 ;
(2)实验开始要尽可能快地把反应温度提高到170℃,其最主要目的是____(填正确选项前的字母);
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(3)在装置C中应加入_____ (填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体;
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用_________洗涤除去 (填正确选项前的字母)。
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)装置B的作用有两个,分别是检查实验进行时试管D是否发生堵塞和_____________。
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
Ⅰ.该小组用右图所示装置进行乙醇制乙烯的实验。当温度迅速上升后,可观察到试管中溴水退色,蒸馏烧瓶中液体呈棕黑色.实验后,将烧瓶中的废液倒入盛有水的塑料桶中。
(1)写出乙醇制乙烯的反应方程式_____________________。该反应属于___________反应。
(2)有一些同学认为:溴水退色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,因为棕黑色物质会与浓硫酸反应生成某气体,该气体能使溴水退色,则该气体与溴水反应的化学方程式为______。
另有一些同学经过细致观察后认为:试管中的另一个现象可证明反应中有乙烯生成且乙烯具有不饱和性.这个现象是_________________。
Ⅱ.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂为___________,出现的主要现象是______________。(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想(请你补足猜想②).:
①溴与乙醛发生取代反应;②溴与乙醛发生加成反应;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量.
(3)方案一是否可行_____(填“是”或“否”),理由是________________________。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)="_______" mol,则说明溴与乙醛发生取代反应。
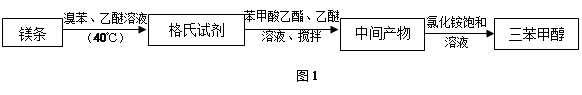
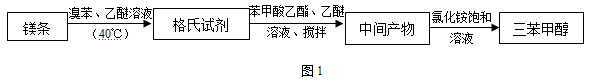
三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
 |
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
| 物质 |
熔点 |
沸点 |
溶解性 |
| 三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
-30.7℃ |
156.2℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
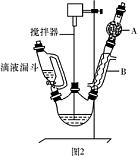
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
 (3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
(10)实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。
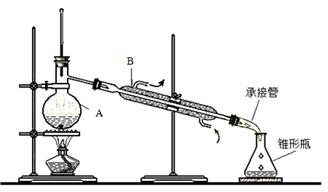
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
c(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
三苯甲醇(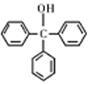 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
已知:(I)格氏试剂容易水解:
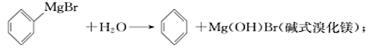
(Ⅱ)相关物质的物理性质如下:
| 物质 |
熔点 |
沸点 |
溶解性[ |
| 三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
-30.7℃ |
156.2℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
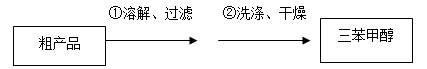
其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
(14分) 某实验小组用下列装置进行乙醇催化氧化的实验。
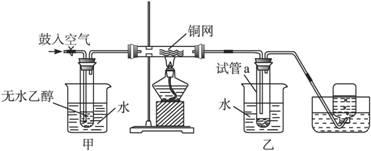
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:_________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是______________。集气瓶中收集到的气体的主要成分是___________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过____________(填实验操作名称)即可除去。
某实验小组用下列装置进行乙醇催化氧化的实验.

(1)实验中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式: .
不断鼓入空气,熄灭酒精灯,反应仍能继续,说明乙醇的氧化应是 反应.
(2)甲和乙两个水浴作用不相同.甲的作用是 ;乙的作用是 .
(3)反应进行一段时后,试管a中能收集到不同的物质,它们是 .集气瓶中收集到的气体的主要成分是 .
(4)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还有 .
要除去该物质,可先在混合液中加入 (填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可除去.
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
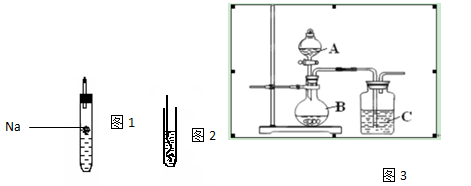
(I)如上图1所示,试管中装乙醇,(图示不一定准确)则反应现象为 ;
(II)如上图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为 ;(填结构简式);
(III)为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图3所示装置来进行实验验证。
①A中所盛试剂为___ ____。
②C中实验现象为 ,由实验可知这三种酸的酸性大小为 。
③该装置中存在不妥之处,请提出改正措施 。
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)写出乙醇制取乙醛的反应原理 。
(2)甲装置常常浸在70~80 ℃的水浴中,目的是 。
(3)由于装置设计上的缺陷,实验进行时可能会 。
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、 接丙。
下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。
(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)________。
(2)B处发生的化学反应方程式为________________________________________。
(3)C处应出现的现象是_________________________________________________,
D处使用碱石灰的作用是_____________________________________________,
E处应出现的实验现象是 ____________________________________________,
F处可以添加的固体药品是 __________________________________________。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由此推断此时B处发生反应的化学方程式为___________。
(共8分)实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出实验室制备乙烯反应的化学方程式: ,实验中,混合浓硫酸与乙醇的方法是将_____________慢慢加入另一种物质中;加热F装置时必须使液体温度___________(选填缓慢或迅速)升高到170℃,圆底烧瓶中加入几粒碎瓷片的作用是 。
(2)为实现上述实验目的,装置的连接顺序为F→______________→D。(各装置限用一次)
(3)当C中观察到 时,表明单质溴能与乙烯反应;若D中 ,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应。
某同学在学习了乙醇的知识后,设计了如图所示的实验。操作步骤及观察到的现象如下:
①在试管里加入2 mL乙醇;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热变黑;
③立即将铜丝插入盛有乙醇的试管里,铜丝重新变为红色光亮,反复操作几次。请回答下列问题:
(1)该实验的目的是_________________________________________。
(2)写出总的反应化学方程式___________________________________。
(3)在此过程中,铜丝的作用是_________________________________。
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。
已知乙醛在加热条件下能与新制Cu(OH)2反应生成Cu2O。
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 (填仪器接口的字母编号)(加热和夹持装置已略去).
(2)B装置中发生的化学方程式 .
(3)F装置中的固体试剂是 ,发生反应的化学方程式为 .
反应一断时间后移去酒精灯,反应能继续进行,其原因是 .
(4)A装置和D装置中的实验现象分别为 .
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见 .