我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量。通常把1升水中含有10mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
实验中涉及的部分反应:M2+(金属离子)+EBT(铬黑T) =M EBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA) = MY2-
MEBT+Y4-(EDTA) = MY2-+EBT(铬黑T)
⑴取地下水样品25.0毫升进行预处理。已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个) ▲ 。预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 ▲ 。
⑵将处理后的水样转移到250 mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100 mol·L-1的EDTA标准溶液进行滴定,滴定时眼睛应 ▲ ,滴定终点时的实验现象是 ▲ 。
⑶滴定终点时共消耗EDTA溶液15.0 mL,则该地下水的硬度= ▲ 。
⑷若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。
水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0°C下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80 mL。已知该温度下水的饱和O2含量为9.08 mg·L-1。
3.在20.0°C下密闭放置5天的水样102.2 mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
5-1 写出上面3步所涉及的化学反应方程式。
5-2 计算标准溶液的浓度(单位mol·L-1)。
5-3 计算新鲜水样中氧的含量(单位mg·L-1)。
5-4 计算陈放水样中氧的含量(单位mg·L-1)。
5-5 以上测定结果说明水样具有什么性质?
将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化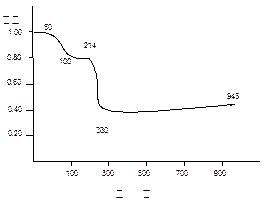
的关系如图所示(相对原子质量:H 1.0, C 12.0, O 16.0, Mn 55.0 ):
纵坐标是固体的相对质量。
说出在下列五个温度区间各发生什么变化,并简述理由:
0~50℃;50~100℃;100~214℃;214~280℃;280~943℃
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-) 
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。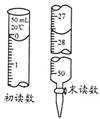
某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
请回答下列问题:
(1)写出II中反应的化学方程式 。
(2)观察到II中的现象是 。
(3)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是 。
(4)能说明苯与液溴发生了取代反应的现象是 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;
⑤ (填操作名称)。