某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |
电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
I.下列是常见的电化学示意图
(1)图①是碱性锌锰电池的构造示意图,在正极反应的物质是_______________(填“Zn”或“MnO2”),正极发生_______反应(填“氧化”或“还原”)。
(2)图②是酸性电解质的氢氧燃料电池工作原理示意图,B极发生的电极反应是________________。
(3)图③表示钢铁发生吸氧腐蚀生锈的示意图,写出氧气发生的电极反应:___________________。
(4)能表示“牺牲阳极的阴极保护法”的示意图是______________(填序号)。图④中,钢闸门连接电源的_____________极而受到保护。在图⑤中标出电子的移动方向。
II.下列是常见的电化学装置图。
(5)图⑥中电池的总反应为__________________(写化学方程式),盐桥中装有含琼胶的KCl饱和溶液,盐桥中Cl-会向_______________(填“左”或“右”)边烧杯中的溶液移动。
(6)检验图⑦中阳极产物的方法和现象是________________。
下列叙述错误的是( )
| A.氢氧燃料电池是一种将化学能转化为电能的装置 |
| B.铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 |
| C.钢铁腐蚀时负极的电极反应式:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水时阴极的电极反应式:2H++2e-=H2↑ |
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。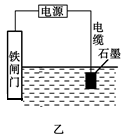
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。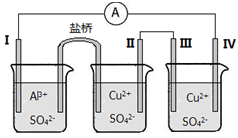
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
下列叙述不正确的是
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |
装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中的Fe电极上的反应式:____________________。
(2)装置乙中被腐蚀的金属是________________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是_____________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图丁。请回答:
A电极对应的金属是____________(写元素名称),B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•xH2O),写出铁发生电化学腐蚀时正极的电极反应: 。
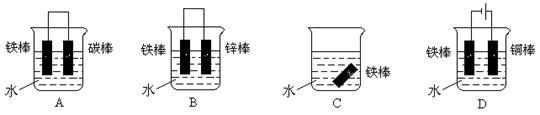
(3)下列哪个装置可防止铁棒被腐蚀 (填字母)。

(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如右图,请回答:
① B电极对应的金属是 (写元素名称),A电极的电极反应式是 。
② 若电镀前两电极的质量相同,电镀完成后, 若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差 g。
下列说法正确的是
| A.马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化 |
| B.原电池反应是导致金属腐蚀的主要原因,故不能用于减缓金属的腐蚀 |
| C.钢铁电化学腐蚀的两种主要类型其主要区别在于水膜的pH不同引起负极反应的不同 |
| D.无论哪种类型的金属腐蚀,其实质都是金属被氧化 |
一定条件下,碳钢腐蚀与溶液pH的关系如下表。下列说法不正确的是( )
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
A.当溶液pH<4,碳钢主要发生析氢腐蚀
B.当溶液pH>13.5,碳钢腐蚀的正极反应式为O2+4H++4e-=2H2O
C.当溶液pH>6,碳钢主要发生吸氧腐蚀
D.煮沸除去氧气的碱性溶液中,碳钢腐蚀速率会减缓
下列实验现象以及结论均合理的是
| A.在一块镀锡铁板刻一划痕,滴加酸化的食盐水浸泡及KSCN溶液,溶液颜色没有变化,判断其具有好的耐腐蚀性 |
| B.测定一定物质的量浓度的某NaA溶液的pH,pH>7,可以说明HA是弱酸 |
| C.在氯化银的悬浊液中加入碘化钠溶液,沉淀颜色不变,说明氯化银的溶解度比碘化银大 |
| D.在酸碱中和滴定中,用标准氢氧化钠溶液测定醋酸溶液的浓度时,用甲基橙做指示剂对滴定终点的判断比用酚酞的更准确 |
在日常生活中,我们经常看到铁制品生镑、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
| A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图I所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl-—2e-—Cl2↑ |
| D.图Ⅲ装置的总反应为4A1+302+6H20——4A1(0H)3,生成的Al(OH)3进一步脱水形成白斑 |
化学与社会、生活密切相关。下列有关说法错误的是
| A.地球上99%以上的溴蕴藏在海洋中 |
| B.用食醋可除去热水壶内壁的水垢 |
| C.在水库铁闸门上接装铜块可减缓铁闸门腐蚀 |
| D.将煤气化或液化可减少污染、提高燃烧效率 |