下列说法不正确的是
| A.2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。利用此类光学显微镜可以观察活细胞内蛋白质等大分子。 |
| B.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
| C.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
| D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
下图各容器中盛有海水,铁在其中被腐蚀时由快到满的顺序是
| A.③>②>④>① | B.②>①>③>④ |
| C.④>②>③>① | D.④>②>①>③ |
a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块如图所示放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.a试管内压强变大,b试管内压强变小 |
C.两试管中相同的电极反应式是:2Fe Fe2++2e- Fe2++2e- |
| D.两试管中均发生了电化腐蚀 |
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应: 。
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ |
1.9 7.0 |
3.2 9.0 |
| Cu2+ |
4.7 |
6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 ; ;劣质不锈钢腐蚀的实验现象 。
金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
| A.纯铁的腐蚀属于电化学腐蚀 |
| B.钢铁吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢ |
| C.海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 |
| D.在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣ |
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:____________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是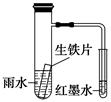
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液pH逐渐减小 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
为了避免青铜器生成铜绿,以下方法正确的是
| A.将青铜器放在银质托盘上 | B.将青铜器与直流电源的正极相连 |
| C.将青铜器保存在潮湿的空气中 | D.在青铜器的表面覆盖一层防渗的高分子膜 |
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是

| A.甲区呈现红色 | B.乙区产生Zn2+ |
| C.丙区发生的电极反应式:Cu-2e-= Cu2+ | D.丁区呈现蓝色 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
下列各种金属防护的方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜,能对金属起到防止或减缓腐蚀作用的是 ( )。
| A.①②③④ | B.①③④⑤ |
| C.①②④⑤ | D.全部 |
如图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈________性,发生________腐蚀,电极反应式为:负极:____________________,正极:____________________。
(3)若试管内液面下降,则原溶液呈________性,发生________腐蚀。电极反应式为,负极:____________________,正极:____________________。
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。