我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第周期。
(2)某青铜器中、
的质量分别为119
、20.7
,则该青铜器中
和
原子的数目之比为。
(3)研究发现,腐蚀严重的青铜器表面大都存在。关于
在青铜器腐蚀过程中的催化作用,下列叙述正确的是。
| A. | 降低了反应的活化能 | B. | 增大了反应的速率 |
| C. | 降低了反应的焓变 | D. | 增大了反应的平衡常数 |
(4)采用"局部封闭法"可以防止青铜器进一步被腐蚀。如将糊状涂在被腐蚀部位,
与有害组分
发生复分解反应,该化学方程式为。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是(填图中字母""或"
"或"
");
②环境中的扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
,其离子方程式为;
③若生成4.29 ,则理论上耗氧体积为
(标准状况)。
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成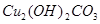 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(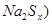 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导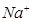 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:
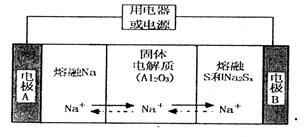
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。

②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的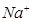 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为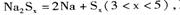 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.