合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度。
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 (用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用 来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应放于 处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
(共8分)中国是世界上最早研究和生产合金的国家之一。合金是被广泛使用的金属材料。
(1)金属腐蚀的现象非常普遍。造成钢铁腐蚀的主要原因是 腐蚀,其负极反应式为 。请例举两种防止铁制品被腐蚀的方法 、 。
(2)钢一般可分为碳素钢和 两大类。根据含碳量的不同,碳素钢可分为 、 和 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。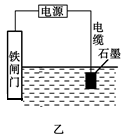
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。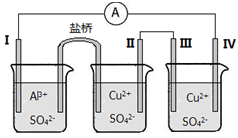
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
金属是人类生产、生活中不可缺少的重要材料
(1)生铁是 (填化学式)和铁的合金,生铁的硬度比纯铁 (填高、低)。
(2)生铁放置在潮湿的空气发生电化学腐蚀时的正极反应为 ;负极反应为 ;用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为 。
(3)下列对金属制品采取的防护方法不正确的是 (填序号)。
①在电线的外面包上一层塑料层
②在自行车钢圈上镀上一层金属铬
③在海轮的铁制外壳上焊上铜块
④在铁制的暖气片上刷一层油漆
(1)反应A+3B 2C+2D在四种不同情况下的反应速率分别如下:
2C+2D在四种不同情况下的反应速率分别如下:
该反应进行的由快到慢顺序为 (填序号)
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如下图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号)_______________。
(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 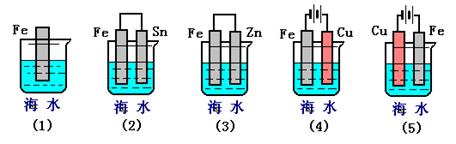
研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为 ,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为 ,这种腐蚀称为 腐蚀,而水膜酸性不强时,正极反应式为 ,这种腐蚀称为 腐蚀。
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法:

(8分)钢铁很容易生锈而被腐蚀。
(1)钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀过程中的电极反应为:
负极_______________ _______________;
正极_______________________________ 。
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 _________(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极上。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:  。
。
II.(1)某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2 S
S O4(稀)=CuSO4+H2↑。请你在右边方
O4(稀)=CuSO4+H2↑。请你在右边方 框内画出能够实现这一反应的装置图。
框内画出能够实现这一反应的装置图。
(2)某同学在做一定条件下铜与稀硫酸的反应实验时,
看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析
其原因: 。
回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:
负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生的电极反应:
正极: 。
装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中的Fe电极上的反应式:____________________。
(2)装置乙中被腐蚀的金属是________________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是_____________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图丁。请回答:
A电极对应的金属是____________(写元素名称),B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A和B区域相比较,腐蚀较慢的是 (填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量 的 ;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x= 。