(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是 ,负极反应式为 ;正极是 ,正极反应式为 。
下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。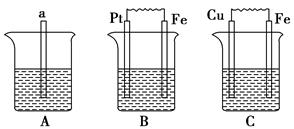
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
金属的防腐常用方法有
| A.覆盖油漆 | B.覆 盖塑料 盖塑料 |
C.电镀金属 |
D.电化学保护法 E.制成不锈钢 E.制成不锈钢 |
请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号):
(1) 邮筒___ ___ ___ (2) 手术刀_____ ___
(3) 海水中的钢闸门________ (4) 电线____ ______
(5) 自行车的钢圈____________。
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是__________极;电极反应式为___________________。
(2)已知: ;
; ,
,
飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电(3600KJ)时能生成360g水,则该电池的能量的利用率为________.
如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____________________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________。
(填序号)。
铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
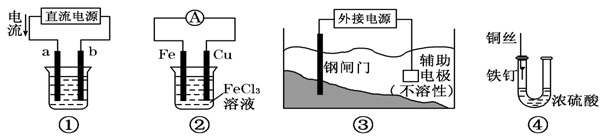
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。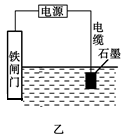
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。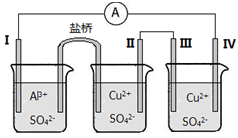
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应,负极: ;正极: 。
(2)为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。 