(1)反应A+3B 2C+2D在四种不同情况下的反应速率分别如下:
2C+2D在四种不同情况下的反应速率分别如下:
该反应进行的由快到慢顺序为 (填序号)
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如下图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号)_______________。
研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为 ,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为 ,这种腐蚀称为 腐蚀,而水膜酸性不强时,正极反应式为 ,这种腐蚀称为 腐蚀。
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法:

合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度。
如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:
负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生的电极反应:
正极: 。
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。
(1)此时在导线上有_______ mol电子通过。
(2)Zn片溶解的质量是_____________ g。
(3)原稀H2SO4的物质的量浓度是______________ mol/L。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为 。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于 处。
回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的pH值 (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是 ,该电极电极反应式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
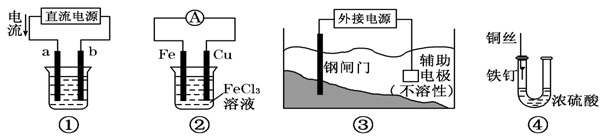
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。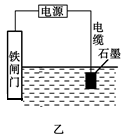
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。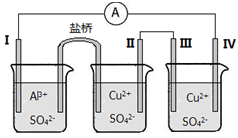
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应,负极: ;正极: 。
(2)为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。 