下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
以下现象与原电池反应无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
表示下列变化的化学用语正确的是
A.Na2CO3的水解:CO32-+H2O H2CO3+2OH- H2CO3+2OH- |
B.用石墨电极电解硫酸铜溶液:2Cu2++4OH- 2Cu+O2↑+2H2O 2Cu+O2↑+2H2O |
| C.钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH- |
| D.草酸使酸性高锰酸钾溶液褪色:2MnO4—+5C2O42—+16H+=2Mn2++10CO2↑+8H2O |
下列说法不正确的是
| A.铸铁输油管道应埋在干燥致密不透气的土壤中 |
| B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH- |
| D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
化学与生产、生活密切相关,下列有关叙述正确的是
| A.晶体硅是"信息革命"的支柱材料,可用作光导纤维 |
| B.将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C.化学反应伴随着能量的变化,反应物总能量一定大于生成物总能量 |
| D.含有碳的铜与稀H2SO4长时间接触会发生吸氧腐蚀 |
下列有关金属腐蚀与防护的说法正确的是
| A.黄铜(铜锌合金)制作的铜锣易产生铜绿 |
| B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上了铬 |
下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀
③电镀时应把镀件置于电解槽的阴极
④冶炼铝时,把氯化铝加热成为熔融态后电解
⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
下列金属防腐的措施中,使用外加电流的阴极保护法的是()
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 |
| C. | 汽车底盘喷涂高分子膜 | D. | 地下钢管连接镁块 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe +2H2O+O2 =2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-= Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-= 4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
铜板上铁铆钉处的腐蚀原理如图所示,下列有关说法中正确的是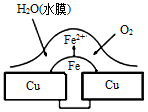
| A.此过程中铜被腐蚀 |
| B.此过程中电子从Cu移向Fe |
| C.正极电极反应式为O2+2H2O+4e-=4OH- |
| D.铁钉表面发生的反应为Fe-3e- ═ Fe3+ |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
分析图像,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 | B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 | D.两溶液中负极反应均为:Fe – 2e→Fe2+ |
下列说法正确的是
| A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用 |
| B.SiO2不溶于强酸和强碱,可用于制光导纤维 |
| C.C12与SO2使品红溶液褪色的原理相同 |
| D.常温下浓硫酸与铝不反应,可用铝槽车运输 |
如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
| A.开始时发生的是析氢腐蚀 |
| B.一段时间后发生的是吸氧腐蚀 |
| C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+ |
| D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2 |
利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是
| A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 |
B.若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O 2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑ |
| C.若X为碳棒,开关K置于B处,在铁棒附近滴入铁氰化钾溶液可看到溶液变血红色 |
| D.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |