埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
| A.在潮湿疏松的碱性土壤中 |
| B.在含铁元素较多的酸性土壤中 |
| C.在干燥致密不透气的土壤中 |
| D.在含碳粒较多,潮湿透气的中性土壤中 |
【改编】下列叙述的原因不是由于原电池造成的是
| A.铁与酸反应滴加硫酸铜后反应加快 |
| B.金属在潮湿空气中更容易腐蚀 |
| C.镀锡铁镀层破损后腐蚀加快 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
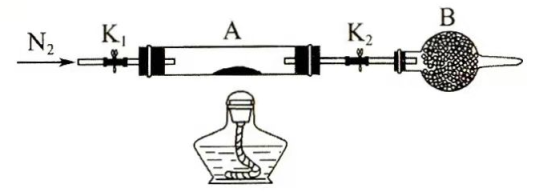
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
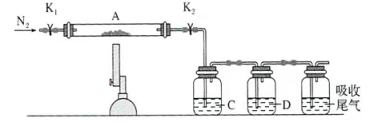
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是
| A.锌作阳极,镀件作阴极,溶液中含有锌离子 |
| B.铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D.锌作阴极,镀件作阳极,溶液中含有亚铁离子 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.铅蓄电池放电的正极电极反应式:PbO2 +4H++2e -==Pb2++2H2O |
| B.氢氧碱性燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH - |
| C.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e- ="=" Cu |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - ="=" Fe2+ |
由下列实验及现象不能推出相应结论的是( )
| |
实验 |
现象 |
结论 |
| A. |
向 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 |
黄色逐渐消失,加KSCN溶液颜色不变 |
还原性: |
| B. |
将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
具有氧化性 |
| C. |
加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 |
石蕊试纸变蓝 |
显碱性 |
| D. |
向2支盛有 相同浓度银氨溶液的试管中分别加入2滴相同浓度的 和 溶液 |
一只试管中产生黄色沉淀,另一支中无明显现象 |
|
下列实验操作规范且能达到目的的是( )
| |
目的 |
操作 |
| A. |
取 盐酸 |
在 酸式滴定管中装入盐酸,调整初始读数为 后,将剩余盐酸放入锥形瓶 |
| B. |
清洗碘升华实验所用试管 |
先用酒精清洗,再用水清洗 |
| C. |
测定醋酸钠溶液 |
用玻璃棒蘸取溶液,点在湿润的 试纸上 |
| D. |
配制浓度为 的 溶液 |
称取 固体 ,放 容量瓶中,加水溶解并稀释至刻度 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
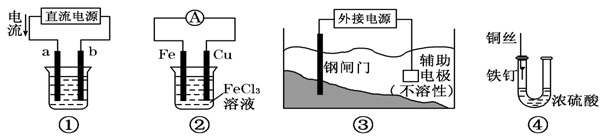
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
| A.纯铁的腐蚀属于电化学腐蚀 |
| B.钢铁吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢ |
| C.海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 |
| D.在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣ |