以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.镀锌层破损后即对铁制品失去保护作用 |
| B.未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
金属腐蚀在生活和生产中相当普遍。下列措施能防止金属腐蚀的是( )
| A.将铜铝导线焊接在一起使用 | B.将输送自来水的铁管表面镀锌 |
| C.经常用自来水冲洗生铁制品 | D.将输油铸铁管道埋在潮湿、疏松的土壤中 |
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______________________。
(3)下列哪些装置可防止铁棒被腐蚀_____________ 。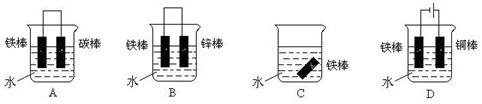
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下: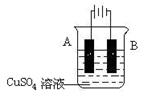
请回答:
① A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。
钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
| A.Fe -2e-= Fe2+ | B.Fe -3e- = Fe3+ |
| C.O2 +2H2O +4e- = 4OH- | D.2H+ + 2e- = H2 ↑ |
下列说法正确的是
| A.所有放热反应均是自发反应,也是熵增大的反应 |
| B.向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 |
| C.锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列说法正确的是 ( )
| A.镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
| B.埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀 |
| C.钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-2e-= Fe2+ |
| D.在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀 |
在铁的吸氧腐蚀中,发生还原反应的那个电极上进行的电极反应是
A. |
B. |
C. |
D. |
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_______________________________________  。
。
(2)铁在潮湿的空气中容易被腐蚀为铁锈( Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的离子方程式______________________________ 。
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________________(填字母) 。
(5)写出两种防护铁生锈的方法。
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)铁被腐蚀的速率由快到慢的顺序是 (填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮
B.海水中的轮船
下列叙述正确的是 ( )
| A.直径介于1nm~100nm 之间的粒子称为胶体 |
| B.气体甲通入溶液乙中溶液乙颜色褪去,说明气体甲一定具有漂白性 |
| C.在海轮外壳上镶入锌块,可减缓船体的腐蚀速度 |
| D.向氯化银悬浊液中滴入碘化钾溶液,有碘化银沉淀生成,说明氯化银的溶解度小于碘化银的溶解度 |
(1)能源是当今社会发展的三大支柱之一。天然气是一种高效、低耗、污染小的清洁能源,主要成分为甲烷,甲烷燃烧的化学方程式为: ;
; 标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。
标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。

 s
s
 在如图构想的物质循环中太阳能最终转化为 能。
在如图构想的物质循环中太阳能最终转化为 能。
 (2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀 的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
负极的电
 极反应式为 ,
极反应式为 , 正极的电极反应式为 。
正极的电极反应式为 。 【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】
【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】 (3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

 操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
| D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈 |
下列事实中,与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属银的表面生成一层黑色物质 |