浙江省温州市高二下学期期末四校联考化学卷
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”的绿色环保主题,中国宣布了2020年二氧化碳排放量下降40~45%的减排目标。下列不符合这一主题的是
| A.自备购物布袋,不用塑料方便袋 |
| B.开发新能源,如太阳能、风能等,减少对化石能源的依赖 |
| C.推广煤的气化、液化技术,提供清洁燃料和化工原料 |
| D.给汽车安装尾气处理器 |
化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是
①鸡蛋白溶液遇浓硝酸——黄色 ②淀粉碘化钾溶液遇碘离子——蓝色
③溴化银见光分解——白色 ④热的氧化铜遇乙醇——红色
⑤新制氯水久置后——无色 ⑥过氧化钠在空气中久置——淡黄色
| A.①②③⑤ | B.①④⑤ | C.②③④⑥ | D.④⑤⑥ |
下列事实中,与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属银的表面生成一层黑色物质 |
在中和热测定的实验中不需要用到的仪器是
| A.量筒 | B.温度计 | C.天平 | D.环形玻璃搅拌棒 |
下列过程或现象与盐类水解无关的是
A 纯碱溶液去油污 B 铁在潮湿的环境下生锈
C 加热氯化铁溶液颜色变深 D 浓硫化钠溶液有臭味
下列说法正确的是
| A.纸层析法分离Fe2+和Cu2+实验中滤纸作为惰性支持物,滤纸上吸附的水作为流动相 |
| B.硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后时用水洗 |
| C.牙膏中的安息香酸钠、氟化钠等溶于水,水解使溶液显酸性。 |
| D.欲分离KNO3和NaCl按物质的量1:1组成的混合物,先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得KNO3晶体;将母液加热至大量晶体析出后,用余热蒸干,得NaCl晶体。 |
某反应A + B =" C" + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是
| A.△H <0 △S >0 | B.△H >0 △S >0 | C.△H <0 △S <0 | D.△H >0 △S <0 |
在25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
| A.C(s)+ O2(g)=CO(g);△H =-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g);△H =+571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H =-890.3 kJ/mol |
| D.C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H =-1400 kJ/mol |
已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+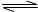 Cr2O72-(橙色)+H2O;
Cr2O72-(橙色)+H2O;
若要使溶液的橙色加深,下列可采用的方法是
| A.加入适量稀硝酸 | B.加入适量稀盐酸 |
| C.加入适量烧碱固体 | D.加水稀释 |
下列说法错误的是
| A.用加热的方法提纯含有少量碳酸氢钠的碳酸钠 |
| B.用盐析的方法分离、提纯蛋白质 |
| C.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸滴定未知浓度的NaOH溶液, 则测定值偏大 |
D.质量m1单侧面积S的镀锌铁皮(锌密度 )放入6mol/L HCl溶液中,到反应速率突然减少时,立即取出铁片,冲洗烘干后称量得质量m2。则锌镀层厚度为 )放入6mol/L HCl溶液中,到反应速率突然减少时,立即取出铁片,冲洗烘干后称量得质量m2。则锌镀层厚度为 = = |
下列鉴别方法可行的是
| A.用氨水鉴别Al3+、Mg2+和Ag+ |
B.用Ba(NO3)2溶液鉴别Cl-、SO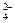 和CO 和CO |
| C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
D.用KM nO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO nO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
根据下列实验现象所做的解释或所得的结论错误的是
| |
操作及现象 |
解释或结论 |
| A |
将一小块刚用酸处理过的铝箔,在酒精灯上加热,铝熔化而不滴落。 |
铝表面很快形成熔点比铝高的氧化膜,氧化膜包住了熔化的铝 |
| B |
将一小块金属钠投入盛有无水乙醇的试管中,钠块表面产生气泡。 |
乙醇分子中含有羟基 |
| C |
向CaCl2溶液中加入过量Na2SO4溶液,静置后向上层清液中滴加Na2CO3浓溶液,产生白色浑浊。 |
白色浑浊为CaCO3,化学反应具有可逆性,化学反应的进程都有一定的限度 |
| D |
向2 mL淀粉溶液中加入稀硫酸,加热2 min,加入新制Cu(OH)2在加热,无明显现象。 |
淀粉在酸性条件下不水解 |
已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
下图中两电极上发生的电极反应如下:a极:2H+ + 2e- = H2↑. b极: Fe-2e-= Fe2+
下列说法不正确的是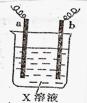
| A.该装置可能是电解池 |
| B.X溶液的pH增大 |
| C.a和b可能是同种电极材料 |
| D.该装置一定是将化学能转化为电能 |
有关如图原电池的说法正确的是
| A.盐桥的作用是让电子通过,以构成闭合回路 |
| B.总反应为:2H++Zn=H2+Zn2+且△H<0 |
| C.随着反应进行,右烧杯中溶液pH变小 |
| D.随着反应进行,左烧杯溶液中的SO42-向右烧杯溶液迁移 |
 一元弱酸HA(aq)中存在下列电离平衡:HA
一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,
下列关系不正确的是:
| A.c(K+)+c(H+) = c(HC2O4-) + c(OH-) + 2 c(C2O42-) |
| B.c(HC2O4-) + c(C2O42-) = 0.1 mol·L-1K |
| C.c(C2O42-) > c(H2C2O4) |
| D.c(K+) = c(H2C2O4) + c(HC2O4-) + c(C2O42-) |
下列叙述正确的是
| A.某醋酸溶液的PH= a,将此溶液稀释1倍后,溶液的PH= b,则a>b |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH< 7 |
| C.1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0 |
| D.若1mL PH=1盐酸与100mL MaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11 |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.65% |
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.电路中共转移0.9mol电子 |
| B.阳极得到的气体中有O2且其物质的量为0.35mol |
| C.阴极质量增加3.2g |
| D.铝元素以Al(OH)3的形式存在 |
(10分)请你按下列要求书写相应的方程式:
(1)用离子方程式解释NaAlO2溶液的碱性:
(2)5.6g金属铁与盐酸完全反应生成氯化亚铁溶液与氢气,同时放出热量Q KJ。
写出此反应热化学方程式: 。
(3)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。已知此燃料电池的负极反应式:CO+CO32--2e-=2CO2
则该电池工作时的正极反应式为: .
(4) FeCl3溶液腐蚀印刷电路铜板的,请写出该离子方程式为: 。
(5)将(4)反应设计成原电池,请在方框内画出原电池的装置图(标出正、负极、溶液)。
某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,设计了以下实验流程图,请回答以下问题:

(1) 写出步骤①中可能发生一个反应的化学方程式 。
(2)为验证气体A,按下图所示进行实验:若能观察到 的现象,即可证明火柴头上含有S元素。

(3) 步骤②的实验操作装置如下图所示

a.该操作的名称是 。
b.写出图中A仪器的名称: __ ___;
c.该装置图有几处错误.
请指出
B仪器处关键性的错误:__________ C仪器处的错误改进后应是: 。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是 。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:

|
请写出有关的离子反应方程式为 ,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是 。纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外 光谱法 c.质谱法 d.透射电子显微镜法
光谱法 c.质谱法 d.透射电子显微镜法
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的 _____(填字母代号)。
_____(填字母代号)。
(4)滴定终点的现象是___________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_______。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
 度为 。
度为 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号