[山东]2012届山东省冠县武训高中高三第二次质量检测化学试卷
“信息”、“材料”和“能源”被称为新科技革命的三大支柱。下列有关说法错误的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C.2011年9月29日成功发射的“天宫一号”目标飞行器使用了大量的复合材料 |
| D.合成高分子材料的广泛应用是有百利而无一害 |
 表示阿伏加德罗常数的值。下列说法正确的是
表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为 |
B.标准状况下,22.4L 与水反应生成1mol硫酸 与水反应生成1mol硫酸 |
C.足量铜与1L 18mol 浓硫酸反应可以得到 浓硫酸反应可以得到 的分子总数为9 的分子总数为9 |
D.标准状况下,22.4L任意比的氢气与氧气的混合气体中含有的分子总数均为 |
下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
| A.反应达平衡时,正反应速率和逆反应速率相等 |
| B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ |
| C.该反应达到平衡状态后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ |
| D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
下列实验操作及现象与结论对应关系正确的一组是
| |
实验操作 |
实验现象 |
实验结论 |
| A |
适量二氧化碳通入氯化钡溶液中 |
产生沉淀 |
碳酸的酸性比盐酸弱 |
| B |
二氧化硫通入溴水中 |
溶液褪色 |
二氧化硫有漂白性 |
| C |
取少量某无色溶液,先加入氯水,再加入少量四氯化碳,振荡、静置 |
溶液分层,下层呈橙红色 |
原无色溶液中一定有溴离子 |
| D |
将铜片放入浓硝酸中 |
产生大量无色气体,溶液变为蓝绿色 |
只体现浓硝酸的强氧化性 |
下列叙述正确的是
| A.非金属原子间以共价键结合的物质都是共价化合物 |
| B.含有共价键的化合物都是共价化合物 |
| C.凡是能电离出离子的化合物都是离子化合物 |
| D.凡是含有离子键的化合物都是离子化合物 |
下列说法正确的是
A.对于 ,若向一密闭容器中加入1mol ,若向一密闭容器中加入1mol 和0.5mol 和0.5mol 充分反应后,放出的热量为0.5 充分反应后,放出的热量为0.5 |
| B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 |
| C.需要加热才能发生的反应不一定是吸热反应 |
D.小苏打在水中的电离方程式: |
下图是电解 溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加入过量氨水 |
B.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合 |
C.在稀氨水中通入过量 |
D.铁片放入过量的稀硝酸中: |
如图中M、N为含X元素的常见化合物,则 X元素为羧
| A.C或Al | B.Cu或Fe | C.N或S | D.Fe或C |
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物 ,下列说法正确的是
,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
C. 可能是离子化合物,也可能是共价化合物 可能是离子化合物,也可能是共价化合物 |
| D.两元素形成的化合物中,原子个数比不可能为1:1 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
A.加热时,a上部聚焦了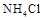 ,说明 ,说明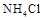 的热稳定性比较好 的热稳定性比较好 |
B.加热时,发现b中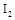 变为紫色蒸气,在上部又聚焦为紫黑色固体 变为紫色蒸气,在上部又聚焦为紫黑色固体 |
| C.加热时,c中溶液红色变深,冷却后又逐渐变浅 |
| D.水浴时,d内气体颜色变浅,e内气体颜色变深 |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为 。下列说法正确的是( )
。下列说法正确的是( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
C.当0.1moZn完全溶解时,流经电解液的电子个数为1.201 |
D.电池正极反应为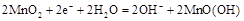 |
下列各组离子一定能大量共存的是
A.常温下PH=1的溶液中: |
B.含有大量 的溶液: 的溶液: |
C.加入铝粉能产生氢气的溶液: |
D.由水电离出的 溶液: 溶液: |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达错误的是
可逆反应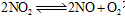 在体积不变的密闭容器中反应,达到平衡状态的标志是:
在体积不变的密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成nmol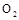 的同时生成2nmol
的同时生成2nmol
②单位时间内生成nmol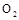 的同时生成2nmol
的同时生成2nmol
③用 的物质的量浓度变化表示的反应速率比为2:2:1的状态
的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①③④ | B.①④⑥ | C.②③⑤ | D.①②③④⑤⑥ |
下列说法或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(金刚石,S)=C(石墨,S); 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定 |
C.在101KPa时,2g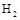 完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为: 完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为: |
D.稀溶液中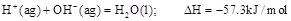 若将含0.5mol 若将含0.5mol 的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ 的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ |
在含有 的溶液中,加入足量的
的溶液中,加入足量的 固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是
固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是
A. |
B.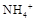 |
C. |
D.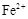 |
向某NaOH溶液中通入 气体后得到溶液M,因
气体后得到溶液M,因 通入的量的不同,溶液M的组成也不同若向M中加入盐酸,产生的气体体积V(
通入的量的不同,溶液M的组成也不同若向M中加入盐酸,产生的气体体积V( )与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计
)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计 的溶解)
的溶解)
A.若OB=0,则形成溶液M所发生的离子方程为 |
B.若OB=BC,则溶液M为 溶液 溶液 |
C.若OB>BC,则溶液M中大量存在的阴离子为 和 和 |
D.若3OB=BC,则溶液M中 |
“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101 时:
时:

则在25℃,101 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为: 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
| A.升高温度 |
B.再充入 |
C.再充入 |
D.将 (g)从体系中分离 (g)从体系中分离 |
E.充入He(g),使体系压强增大
Ⅰ某化学过程的示意图如图所示。在装置工作过程中,甲池的总反应式为: 。试回答下列问题:
。试回答下列问题:
(1)甲池溶液中的 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极,
乙池溶液中的 移向 (填“ A”或“B”)电极;
移向 (填“ A”或“B”)电极;
(2)电极a上发生的电极反应式为 ;
(3)乙池中发生反应的离子方程式为 ;
(4)当电极A处得到0.71g产物时,甲池中理论上消耗
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。
Ⅱ某研究性学习小组对铝热反应实验展开研究。现行高中化学教材对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知, 熔点、沸点数据如下:
熔点、沸点数据如下:
| 物质 |
Al |
 |
 |
 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理 (填“合理”或“不合理”)
用一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂 ,反应的离子方程式为 。
实验室溶解该熔融物,下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D. 氢氧化钠溶液
实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应: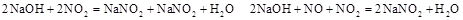
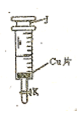
1.NO的制备
(1)在加药品之前首先应进行的操作是 (填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部。
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验)。
(4)将注射器插入稀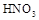 中,吸取适量的稀
中,吸取适量的稀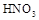 ,然后迅速关闭阀门K,请回答此时可能观察到的实验现象: 。
,然后迅速关闭阀门K,请回答此时可能观察到的实验现象: 。
反应的离子方程式为: ,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
Ⅱ.NO性质实验
(1)观察注射器内气体呈 色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈 色,反应的化学方程式为: 。
(2)向下快速推动活塞J,注射器内气体颜色变化情况为: ,原因是
(结合化学方程式并配以必要的文字说明)。
1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的 极反应物。
(2)化合物 所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为 。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1) 黄铁矿( )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 ,有3mol
,有3mol 参加反应,转移 mol电子。
参加反应,转移 mol电子。
(2) 氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3) 与明矾相似,硫酸铁也可用作净水剂,其原理是
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号