下列事实能说明氯化氢是共价化合物的是( )
| A.其水溶液能导电 | B.极易溶于水 |
| C.是一种具有刺激性气味的气体 | D.熔化状态下不导电 |
分类是化学学习和研究中的常用手段,下列分类依据和结论都正确的是
| A.浓HC1、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸 |
| B.Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属电解质 |
| C.NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物 |
| D.金刚石、二氧化硅、碳化硅晶体中的原子均以共价键结合,都属原子晶体 |
盛有一向定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是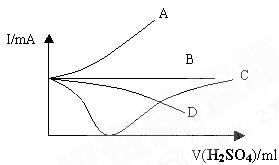
某混合溶液中所含离子及浓度(mol/L)如下表,则M离子及a值可能为( )
| 所含离子 |
NO3- |
SO42- |
H+ |
Na+ |
M |
| 浓度 |
3 |
1 |
2 |
1 |
a |
A.Mg2+ 1 B.Ba2+ 0.5 C.Al3+ 1.5 D.OH- 1
某溶液中含有Ag+、 Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确的是
Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确的是
| A.Na2CO3 、NaCl 、NaOH | B.NaCl 、Na2CO3 、NaOH |
| C.NaOH 、NaCl 、Na2CO3 | D.NaCl 、NaOH 、Na2CO3 |
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
| A.甲一定是氢氧化钙溶液 | B.乙一定是硝酸钾溶液 |
| C.丙不可能是碳酸钠溶液 | D.丁只能是盐酸 |
下列叙述正确的是 ( )
| A.氯化钠溶液在电流作用下电离成Na+与Cl‑ |
| B.溶于水后能电离出H+的化合物都是酸 |
| C.氯化氢溶于水后能导电,但液态氯化氢不能导电 |
| D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
下列电离方程式错误的是 ( )
A.H2CO3 2H+ +CO32- 2H+ +CO32- |
B. NaHSO4(溶液)=Na++H++SO42- |
| C.NaHCO3=Na++HCO3- | D. Ba (OH)2=Ba2++2OH- |
下列电离方程式正确的是 ( )
| A.Al2(SO4)3=Al3++SO42- | B.H2SO4===2H++SO42- |
| C.Ba(OH)2=Ba2++(OH-)2 | D.KHCO3 = K+ +HCO3- |
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )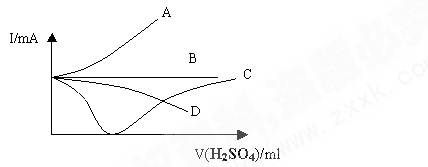
有关电解质的说法正确的是 ( )
| A.纯水的导电性很差,所以水不是电解质 |
| B.SO3水溶液的导电性很好,所以SO3是电解质 |
| C.液态的铜导电性很好,所以铜是电解质 |
| D.Na2O液态时能导电,所以Na2O是电解质 |
关于强弱电解质的叙述不正确的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.同一弱电解质溶液,温度不同时,导电能力不同 |
| C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| D.强电解质在固态或液态时,可能不导电 |
三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl—,则SO42—的物质的量为
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
向0.1mol·L-1的H2SO4溶液中滴入0.1mol·L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(1)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是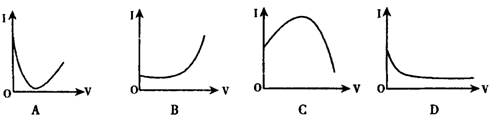
下列叙述正确的是
A.氯化钠溶液在电流作用下电离成氯离子和钠 离子 离子 |
| B.溶于水后电离出氢离子的化合物都是酸 |
| C.硫酸钡难溶于水.但硫酸钡是强电解质 |
| D.氨气溶于水能部分电离,故氨气属于弱电解质 |