[山东]2011-2012学年山东省兖州市高一上学期期中考试化学试卷
某婴儿配方奶粉部分营养成分的含量如下表所示:
| 营养成分 |
钙 |
磷 |
铁 |
锌 |
| 含量/(mg/100g) |
600 |
520 |
6-11 |
3-7 |
表中的“钙、磷、铁、锌”应理解为
A.金属 B.非金属 C.元素 D.分子
下列叙述正确的是
A.氯化钠溶液在电流作用下电离成氯离子和钠 离子 离子 |
| B.溶于水后电离出氢离子的化合物都是酸 |
| C.硫酸钡难溶于水.但硫酸钡是强电解质 |
| D.氨气溶于水能部分电离,故氨气属于弱电解质 |
下列离子方程式书写正确的是
| A.石灰石与盐酸反应 CO32- +2H+=H2O+CO2↑ |
B.醋酸与烧碱溶液反 应 H++OH-=H2O 应 H++OH-=H2O |
| C.氧化铜与盐酸反应 O2-+2H+=H2O |
| D.硫酸与氨水混合 H++NH3·H2O=NH4++H2O |
下列说法正确的是
| A.32g O2占有的体积约为22.4L |
| B.22.4L N2含有阿伏加德罗常数个氮分子 |
| C.在标准状况下,22.4L水的质量约为18g |
| D.22g CO2与标准状况下11.2L HCl含有相同的分子数 |
下列三个反应中,过氧化氢所起的作 用是
用是
①H2O2+H2S=2H2O+S↓;②2H2O2=2H2O+O2↑;③H2O2+Cl2=2HCl+O2↑
| A.起相同作用 | B.只起氧化剂作用 |
| C.起不同作用 | D.只起还原剂作用 |
在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是
| A.FeCl3溶液具有杀菌消毒作用 |
| B.FeCl3溶液能使血液发生聚沉而止血 |
| C.FeCl3溶液能产生块状固体堵住伤口 |
| D.FeCl3溶液能使血液发生化学变化 |
NA表示阿伏加德罗常数的值,下列关于0.2mol·L-1的Ba(NO3)2溶液的说法不正确的是
| A.2L溶液中有阴、阳离子总数为1.2NA |
| B.500mL溶液中NO3-离子浓度为0.2mol·L-1 |
| C.500mL溶液中Ba2+离子浓度为0.2mol·L-1 |
| D.500mL溶液中NO3-离子总数为0.2NA |
12mL浓度为0.1mol·L-1Na2SO4溶液,恰好与40mL浓度为0.01 mol·L-1K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中得化合价是
| A.0 | B.+2 | C. +3 | D.+6 |
欲配制下列四种含大量阴、阳离子的溶液,其中不能配制成功的是
| A.Ca2+、K+、Cl-、CO32- | B.Ba2+ 、Na+、OH-、NO3- 、Na+、OH-、NO3- |
C.Mg2+、Ca2+、C l-、NO3- l-、NO3- |
D.K+、Al3+、Cl-、NO3- |
下列物质分类的正确组合是
| |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
Na2CO3 |
H2SO4 |
NaOH |
SO2 |
CO2 |
| B |
NaOH |
HCl |
NaCl |
Na2O |
CO |
| C |
NaOH |
CH3COOH |
CaF2 |
CO |
SO2 |
| D |
KOH |
HNO3 |
CaCO3 |
CaO |
SO3 |
下列叙述正确的是
| A.直径介于1nm~100nm之间的微粒称为胶体 |
B.利用 丁达尔现象可以区别溶液和胶体 丁达尔现象可以区别溶液和胶体 |
| C.电泳现象可证明胶体属于电解质溶液 |
| D.胶体粒子很小,可以透过半透膜 |
根据下列化学反应方程式: (1)2FeCl3+2KI===2FeCl2+l2+2KCI; (2)2FeCl2+C12=2FeCl3
(1)2FeCl3+2KI===2FeCl2+l2+2KCI; (2)2FeCl2+C12=2FeCl3
判断下列物质的氧化能力由强到弱的顺序是
| A.2FeCl3>C12>I2 | B.C12>I2>FeCl3 |
| C.I2>Cl2>FeCl3 | D.C12>FeCl3>l2 |
向0.1mol·L-1的H2SO4溶液中滴入0.1mol·L-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(1)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是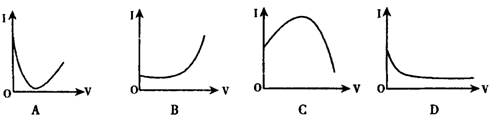
下表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明。
| 配料 |
氯化钠、碘酸钾(KIO3) |
| 含碘量 |
20-40mg·kg-1 |
| 保质期 |
18个月 |
| 食用方法 |
勿长时间炖炒 |
| 贮藏指南 |
避热、避光、密封、防潮 |
(1)碘酸钾属于__________(填“氧化物”、“酸”或“盐”),其中碘元素的化合价为__________;
(2)根据“加碘食盐”的食用方法,可推测碘酸钾在受热时__________________。
草木灰中富含钾盐,主要成分是碳酸钾。现从草木灰中提取钾盐,并用实验检验其中的SO42-、CO32-和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品②溶解和沉淀
③ ④ ,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示:
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻重,样品重 |
(3)在进行②③④操作时都要用到玻璃棒,其作用分别是
 、 、
、 、
(4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在三支试管里。
①在第一支试管里加入稀盐酸,可观察有 生成,证明溶液中有 离子。
②在第二支试管里加入足量稀盐酸后,再加入氯化钡溶液,可观察有 生成,证明溶液中有 离子。
③在第三支试管里加入足量稀硝酸后,再加入硝酸银溶液,可观察有 生成,证明溶液中有 离子。
请把符合要求的化学方程式的编号填入直线上。
(1)既属于分解反应又是氧化还原反应的是 。
(2)属于化合反应,但不是氧化还原反应的是 。
(3)既属于化合反应,又是氧化还原反应的是 。
(4)属于分解反应,但不是氧化还原反应的是 。
(5)不属于四 种基本反应类型的氧化还原反应的是 。
种基本反应类型的氧化还原反应的是 。
A.2NaHCO3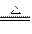 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
B.2Na+Cl2 2NaCl 2NaCl |
| C.Zn+CuSO4=ZnSO4+Cu | D.2KMnO4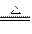 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
E.CaO+CO2=CaCO3 F.4FeS2+11O2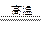 2Fe2O3+8SO2
2Fe2O3+8SO2
在编号为A、B、C、D的四支试管中分别盛有NaHSO4、NaHCO3、BaCl2、BaCO3固体,在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来,在你设计的实验方案中:
(1)已知NaHSO4溶于水发生电离:NaHSO4=Na++H++SO42-,根据物质的溶解性不同,最先检验出来的固体是_______,随后枪验出的第二种物质是_______;
(2)后两种固体被检验出来时发生反应的离子方程式分别是
____________________________________、____________________________________。
一个体重50kg的健康人含铁元素2g。这2g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物 中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行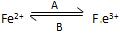 的转化,在过程A中,Fe2+被___________,过程B中
的转化,在过程A中,Fe2+被___________,过程B中 ,Fe2+是
,Fe2+是 ___________产物;
___________产物;
(2)“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做_________剂,具有_________性。
实验室配制500mL0.5mol·L-1的NaOH溶液,有如下操作步骤:
①把称好的NaOH放入小烧杯中。加入适量的蒸馏水溶解、冷却;
②把①所得溶液小心转入500mL容 量瓶中;
量瓶中;
③继续向容鳍瓶中加蒸馏水 至液面距刻度线l~2cm处,改用胶头滴管小心加蒸馏水至溶液凹液面底部与刻度线相切;
至液面距刻度线l~2cm处,改用胶头滴管小心加蒸馏水至溶液凹液面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯2~3次,每次洗涤的液体都小心用同一玻璃棒引流转入容最瓶并轻轻摇匀;
⑤将容 量瓶塞紧瓶塞,充分摇匀。
量瓶塞紧瓶塞,充分摇匀。
回答下列问题:
(1)要配制氢氧化钠溶液,在用托盘天平称量氢氧化钠固体时,托盘天平的读数是________
(填代号,下同);
A.10.0g B.10.00g C.> 10.0g
10.0g  D.<10.0g
D.<10.0g
(2)本实验操作步骤的正确顺序是(填序号)_____________________;
(3)本实验用 到的基本仪器除了天平、药匙、玻璃棒、烧杯以外,
到的基本仪器除了天平、药匙、玻璃棒、烧杯以外,
还需要的仪器有_________________;
(4)某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响? ____________________(填“偏高”、“偏低”或“无影响”);
(5)在配制溶液的过程中,下列操作能造成结果偏低的是________________。
A.容量瓶不干燥,含有少量蒸馏水 B.溶解所用的烧杯未洗涤
C.称量NaOH固体时,所用的砝码生锈 D.定容后摇匀,发现液面低于刻度线



 粤公网安备 44130202000953号
粤公网安备 44130202000953号