[浙江]2011-2012学年浙江省嘉兴市八校高一上学期期中联考化学试卷
在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
| A.元素 | B.单质 | C.分子 |
D.氧化物 |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪)。关于185Hf的下列说法中,正确的是
| A.是一种新元素 | B.原子核内有185个质子 |
| C.原子核内有185个中子 | D.是183Hf的一种新的同位素 |
每做一次焰色反应实验,都要用一种试剂洗净铂丝,这种试剂是
| A.稀盐酸 | B.NaOH溶液 | C.稀硫酸 | D.Na2CO3溶液 |
下列反应中不属于氧化还原反应的是
| A.Cl2+2NaOH ="=" NaCl+NaClO+H2O | B.NH3+HCl == NH4Cl |
| C.Br2+2KI ="=" I2+2KBr | D.2H2O2="=" 2H2O+O2↑ |
下列溶液中的c (Cl -)与50mL1mol·L-1氯化铝溶液中的c (Cl -)相等的是
| A.150mL 1mol·L-1氯化钠溶液 | B.75mL 2mol·L-1氯化铵溶液 |
| C.150mL 3mol·L-1氯化钾溶液 | D.75mL 2mol·L-1氯化钡溶液 |
下列关于Na2CO3的分类叙述错误的是
| A.Na2CO3属于钠盐 | B.Na2CO3 俗名为纯碱,故它属于碱类 |
| C.Na2CO3属于碳酸盐 | D.Na2CO3属于含氧酸盐 |
用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L H2O含有的分 子数为1 NA 子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
C.通常状况下,1 NA 个CO2分子占有的体积为22.4L 个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
向盛有KBr溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是
A.上层橙红色,下层接近无色 |
B.均匀、透明、紫红色 |
| C.上层接近无色,下层橙红色 | D.均匀、透 明、无色 明、无色 |
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol·L-1,c(Mg2+)=0.25mol·L-1,c(C l-)=0.20mol·L-1,则c(SO42-)为
l-)=0.20mol·L-1,则c(SO42-)为
| A.0.15mol·L-1 | B.0.10mol·L-1 | C.0.25mol·L-1 | D.0.20mol·L-1 |
在原子中,与核电荷数不一定相 等的是
等的是
| A.质子数 | B.中子数 | C.核外电子数 | D.原子核带的电荷数 |
"神舟七号"的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A、质子数之比为1:2:3 B、中子数之比为1:1:1
C、摩尔质量之比为8:9:10 D、化学性质不相同
下列各步变化:A[HCl]→B[Cl2]→C[Ca(ClO)2]→D[HClO]→E[CO2],其中不能直接实现的是
| A.A→B | B.B→C | C.C→D | D.D→E |
下列关于氯水的说法正确的是
| A.新制的氯水只含有氯气分子和水分子 |
| B.新制氯水可使紫色石蕊试液先变红后褪色 |
| C.光照氯水有气泡逸出,该气体主要是氯气 |
| D.新制氯水久置后漂白性增强 |
有关电解质的说法正确的是
| A.固体NaCl不导电,所以NaCl不是电解质 |
| B.SO3水溶液的导电性很好,所以SO3是电解质 |
| C.液态的铜导电性很好,所以铜是电解质 |
| D.Na2O液态时能导电,所以Na2O是电解质 |
下列氯化物中,不能用金属和氯气直接反应制得的是
| A.CuCl2 | B.NaCl | C.FeCl2 | D.MgCl2 |
同温同压下,已知气体的密度与它的摩尔质量成正比,一只气球若放在空气(空气的平均分子量为29)中静止不动,那么在相同条件下,该气球放在下列气体中会下沉的是
| A.H2 | B.Cl2 | C.CO2 | D.O2 |
下列电离方程式的书写正确的是
| A.CuCl2= Cu + Cl2↑ | B.Na2CO3= 2Na+ + CO32- |
C.KClO3 K++Cl-+3O2- K++Cl-+3O2- |
D.Ba(OH)2 = Ba 2++ (OH)-2 |
实验室里需要500mL 0.100mol·L-1的CuSO4溶液,以下配制操作正确的是
A.称取7.68gCuSO4,加入500mL水 |
B.称取12.0g胆矾,配成500mL溶液 |
| C.称取8.0gCuSO4,配成500mL溶液 | D.称取8.0g胆矾,配成500mL溶液 |
用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
| A.漂白粉被氧化了 |
| B.有色布条被空气中的氧气氧化了 |
| C.漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO |
| D.漂白粉溶液蒸发掉部分水,其浓度增大 |
在标准状况下,如果11. 2L氧气含有n个氧原子,则阿伏加德罗常数可表示为
2L氧气含有n个氧原子,则阿伏加德罗常数可表示为
| A.n | B.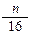 |
C.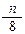 |
D.4n |
下列括号中的物质是除去杂质所需的药品,其中错误的是
| A.NaCl中有杂质Na2SO4(氯化钡) |
| B.FeSO4中有杂质CuSO4(铁粉) |
| C.CO2中有少量CO(灼热的氧化铜) |
| D.CO2中有少量HCl气体(氢氧化钠溶液) |
在某密闭容器中通入amolNO和bmolO2,发生反应:2NO+O2=2NO2,反应后容器内氮原子和氧原子之比为
| A.a:b | B.a:(a+2b) | C.a:2b | D.a:2(a+b) |
下列说法正确的是
| A.标准状况下,22.4LCO2与22.4LH2SO4含有相同的分子数。 |
| B.22.4L气体所含的分子数一定大于11.2L气体所含的分子数。 |
| C.常温下32gO2含分子数小于NA个。 |
| D.标准状况下,1mol氧气和氮气的混和气体(任意比)的体积约为22.4L。 |
检验氯化氢气体中是否混有Cl2,可采用的方法是
| A.用干燥的蓝色石蕊试纸 | B.干燥的有色布条 |
| C.气体中通入硝酸银溶液中 | D.湿润的淀粉碘化钾试纸 |
下列实验操作中错误的是 
| A.蒸发结晶时应将溶液蒸干 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| D.称量时,应该遵循“左物右码”的原则 |
两份物质的量相同的CH4和CO2比较,下列结论正确的是
| A.分子个数比为5∶3 | B.碳原子个数比为1∶1 |
| C.体积比为1∶1 | D.质量比为11∶4 |
某溶液中含有Ag+、 Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确的是
Ba2+、Mg2+,为了将这三种离子逐一进行沉淀分离,加入下列物质先后顺序正确的是
| A.Na2CO3 、NaCl 、NaOH | B.NaCl 、Na2CO3 、NaOH |
| C.NaOH 、NaCl 、Na2CO3 | D.NaCl 、NaOH 、Na2CO3 |
已知反应3S+6KOH(浓)===2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是
| A.2∶1 | B.1∶3 | C.3∶1 | D.1∶2 |
⑴1mol H2SO4中含______mol个氧原子, 个氢原子。
⑵3.6g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是 。
按要求写出下列方程式:
氯气通入氢氧化钠溶液
氯化铵和氢氧化钠共热
Al2(SO4 ) 3的电离方程式
在63Li、73Li、2311Na、2412Mg、146C、147N中, 63Li和73Li 互称 146C和 147N的 相等(填质子数,中子数,质量数,电子数,下同),2311Na和2412Mg的 相等.
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。
(1)需称量___________g烧碱
(2)配制过程中,不需要的仪器(填写代号)____________________
a、烧杯 b、托盘天平 c、玻璃棒 d、1000mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的玻璃仪器有____________
(4)步骤B通常称为转移,步骤A通常称为
(5)将上述实验步骤A到F按实验过程先后次序排列
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.忘记将洗涤液转入容量瓶; |
| B.容量瓶洗涤后底部内壁有水珠而未作干燥处理; |
| C.定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线; |
| D.定容时俯视刻度线; |


 粤公网安备 44130202000953号
粤公网安备 44130202000953号