(14分)(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (初始压强用P0表示)。
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= 。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)____ C(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下: 方法一:将碳酸锂、乙酸亚铁[(CH3COO)
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

 请回答下列问题:
请回答下列问题: (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
。 (2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
、 (填化学式)生成。 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。 (4)写出M与足量氢氧化钠溶液反应的化学方程式:
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
。 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
。
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式);依据所学关于电镀的原理,分析该电镀过程中可选用的电极材料为阳极: ;阴极: 。
③NaH2PO2是 (填“正盐”还是“酸式盐”),其溶液显 性(填“弱酸性”、“中性”、或者“弱碱性”),其溶液中离子浓度由大到小的顺序应为
(3)(H3PO2)也可以通过电解的方法制备。
工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中。
向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,发生了两个氧化还原反应,产物分别为NO2-和NO3-,写出酸性条件下生成NO3-的反应的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)方法I中,用炭粉在高温条件下______________(填氧化、还原)CuO。
(2)方法II采用离子交换膜控制电解液中OH‾的浓度而制备纳米Cu2O,装置如图所示:该电解池的阳极反应式为_____________________________,该装置中的离子交换膜为_____________(填阴、阳)离子交换膜。
(3)方法III为加热条件下用液态肼(N2H4)还原新制Cu(OH)2 来制备纳米
级Cu2O,同时放出N2。该制法的化学方程式为_______________________________________。
(4)在相同的密闭容器中,用以上三种方法制得的Cu2O分别进行催化分解水的实验:
水蒸气的浓度随时间t变化如下表所示。
a.实验①前20 min的平均反应速率v(H2)= _____________
b.实验②比实验①所用的催化剂催化效率_____________ (填高、低)
c.实验的温度T2 _____________Tl(填>、<),原因是____________________________________________。
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子反应方程式: 。残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为 mol·L—1,Fe2+的浓度为 mol·L—1
甲醇是未来重要的绿色能源之一,以CH4和H2O为原料,通过下列反应来制备甲醇
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的0.6倍,则平衡时A容器中H2的体积分数为 。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为 L。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式 ;
②写出除去甲醇的离子方程式 。
(14分)下图为细菌冶铜和火法冶锎的主要流程。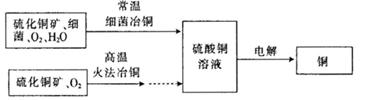
(1)硫酸铜溶液一般不呈中性,原因是__ _____(用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:_____ _________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为_____ ___________(写出一点即可)。
(3)用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。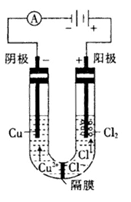
下面是关于棕褐色溶液成分的探究
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?______(填“正确”或“不正确"),原因是_____ _ _____。
资料1:一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是____ ____(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量____ ____固体于试管中,加入__ _____使其溶解,再加入___ ____溶液,观察现象。
④已知电解前,U形管中加入了100mL0.5 mol.L-1 CuCl2溶液,电解结束时电路中一共转移了0.03 mol电子,且阴极生成0.64 g铜,则形成的低价阳离子的物质的量为_____mol。
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___ ____(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):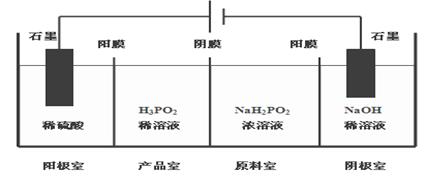
①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
(12分)电化学原理常应用于工农业生产、对工业废水和生活污水进行处理。
(1)对工业废水进行处理是防止水体污染、改善水质的主要措施之一,含氰废水中的CN-有剧毒。
①CN-中碳元素显+2价,则非金属性N C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)某研究性学习小组模拟工业生产,将下列装置如图连接,C、D、E、X、Y 都是石墨,F是铁,丙是模拟精炼铜。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
①电源 B 极的名称是________
②甲装置中电解反应的总化学方程式是:___________ _。
③通电一段时间后,丙中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
④装置丁中的现象是_________________________________ _______。
(3)对生活污水进行处理是防止水体污染、改善水质的主要措施。电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
① 阳极的电极反应式为 。
② 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若降低温度,将NO2(g)转化为N2O4(l),已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2 ;下列能量变化示意图2中,正确的是(选填字母) 。
N2O4(l)ΔH2 ;下列能量变化示意图2中,正确的是(选填字母) 。 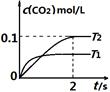
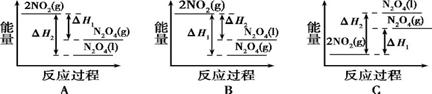
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,某化学课外小组用CH4可以消除NOX对环境的污染。已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H<0
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160KJ/mol
现有某NO2、NO的混合气体,同温同压下密度是氢气的17倍,用16g CH4恰好完全反应生成N2、CO2(g)、H2O(g),放出热量1042.8KJ。则△H为( )
| A.-925.6KJ/mol | B.-867 KJ/mol | C.-691.2 KJ/mol | D.-574 KJ/mol |
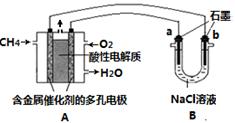 (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
(14分)金属铜具有良好的导电性和导热性,在电气和电子工业中应用广泛。请回答下列问题:
(1)资料显示:加热条件下氨气能够还原CuO得到金属铜。某同学用装置I和Ⅱ制取纯净干燥的氨气,装置I中应选用试剂______(供选用的试剂有:NH4Cl固体、NH4HCO3固体),试剂a最好选用__________,其作用是_________________________________________;装置III吸收尾气,如何检验所得溶液中数目最多的阳离子(只回答试剂名称和实验现象)_____________________。
(2)电解硫酸铜溶液也可得到金属铜。
①以黄铜矿(主要成份为CuFeS2)为原料采用电解法可制取硫酸铜溶液。实验室用如图所示装置模拟其过程,阳极区稀硫酸的作用是溶解矿粉得到Cu2+、Fe2+、H2S,硫酸铁的作用是氧化吸收H2S,防止逸出造成污染。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是(用电极反应式回答)______________,阴极上先有固体析出,然后又溶解,阴极区通入O2的作用是(用离子方程式回答)__________________。
②用惰性电极电解一定浓度CuSO4溶液制取金属铜,一段时间后停止通电,此时加入9.8gCu(OH)2恰好能使电解质溶液恢复至初始状态,则该过程中阳极产生气体的体积为____________L(标准状况)。
(13分)Ⅰ:已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 ___________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ下图中,是电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3。
(1)阳极发生的电极反应式为 。
(2)需补充物质A,A是_____________,说明理由:________________。
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用 。
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用 。
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需 ,下列滴定方式中(夹持部分略去),最合理的是 (填序号)
写出滴定反应的离子方程式___ __。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中 的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)。
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1 g。
方案二:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得固体的质量为n2 g。
试评价上述两种实验方案:其中正确的方案是 ,据此计算得x= (用含m、n1或n2的代数式表示)。
(6)某同学想利用氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL)。
试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接 , 接 ;B接 , 接 ;
(7)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电。将U形管内的溶液倒入烧杯,其pH约为 。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
②C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
③Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g) △H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。已知肼与氨相似,则它与足量盐酸反应的方程式
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。
2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高