甲醇是未来重要的绿色能源之一,以CH4和H2O为原料,通过下列反应来制备甲醇
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与H2O(g)反应成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1.
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3mol H2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的0.6倍,则平衡时A容器中H2的体积分数为 。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6a L,则打开K2之前,B容器的体积为 L。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图3装置模拟上述过程:
①写出阳极电极反应式 ;
②写出除去甲醇的离子方程式 。

 丙”转化的离子方程式:。
丙”转化的离子方程式:。 乙”转化的离子方程式:。.
乙”转化的离子方程式:。.
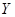 受热分解的化学方程式是。
受热分解的化学方程式是。 常温下是液体
常温下是液体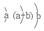

 粤公网安备 44130202000953号
粤公网安备 44130202000953号