(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):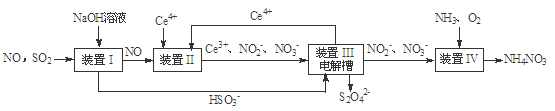
(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中。
向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,发生了两个氧化还原反应,产物分别为NO2-和NO3-,写出酸性条件下生成NO3-的反应的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。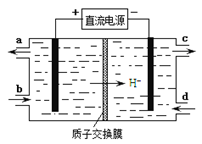
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
 业产品。C的焰色反应为黄色,E、F的相对分子量之间的关系为
业产品。C的焰色反应为黄色,E、F的相对分子量之间的关系为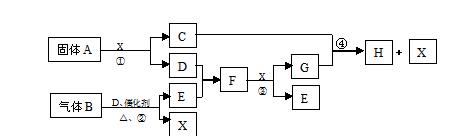
 。
。 钠反应的是(填序号)
钠反应的是(填序号) 入沸水中,继续加热可得红褐色液体,此液体不具有
入沸水中,继续加热可得红褐色液体,此液体不具有 的性质是A.光束通过该液体时形成光亮的“通路”
的性质是A.光束通过该液体时形成光亮的“通路”
 D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键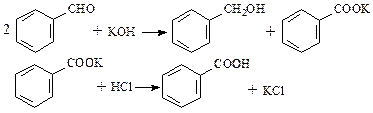
 萃取的效果 ▲(填“好”或“差”)。
萃取的效果 ▲(填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲(填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲(填字母代

 0分)汽车尾气中含有CO、NO2
0分)汽车尾气中含有CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。 ΔH= ▲。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲
ΔH= ▲。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲ (填代号)。
(填代号)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号