关于镀铜和电解精炼铜,下列说法中正确的是( )
| A.都用粗铜作阳极、纯铜作阴极 |
| B.电解液的成分都保持不变 |
| C.阳极反应都只有Cu-2e-=Cu2+ |
| D.阴极反应都只有Cu2++2e-=Cu |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式 C2H5OH+16OH--12e-==2CO32-+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,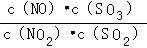 的值及SO2转化率不变 的值及SO2转化率不变 |
用惰性电极电解饱和NaCl溶液。下列有关的说法中,正确的是
| A.在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近滴入KI溶液,溶液呈棕色 |
| C.用阳离子交换膜电解,可防止C12进入阳极室 |
| D.,将电解后的溶液转移到烧杯中,搅拌后溶液呈中性 |
用图所示装置除去含CN—、Cl—废水中的CN—时,控制溶液pH为9~10,阳极产生的ClO—将CN—氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的反应式为:Cl-+2OH- -2e-=ClO-+H2O |
| C.阴极的反应式为:2H2O+2e-=H2↑+2OH- |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
下列说法错误的是
| A.电解饱和食盐水可制取烧碱、氯气、氢气 |
| B.从海水中可提取镁、溴、碘等物质 |
| C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ |
| D.在镀件上镀铜,镀件作阴极 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= +4H2O +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb+PbO2+4H+ 2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
| A.放电时负极反应式为Pb-2e﹣+SO42﹣=PbSO4 |
| B.充放电时,溶液的导电能力变化不大 |
| C.以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D.充电时的阳极反应式为Pb 2++2e-+4OH﹣=PbO2+2H2O |
如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:

(1)甲池若为用电解原理精炼铜的装置,
B电极是 极,材料 A电极反应式为 ,
电解质溶液可以是
(2)乙池中Fe极是 极,若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色,若C电极
材料为石墨,C电极反应式为
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 ,电极反应式为 。
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是( )
| A.粗铜与直流电源负极相连 |
| B.相同时间内阳极质量变化与阴极质量变化可能不同 |
| C.硫酸铜溶液浓度始终保持不变 |
| D.杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是
| A.铜电极上发生还原反应 |
| B.石墨电极附近溶液呈红色 |
| C.溶液中的Na+向石墨电极移动 |
| D.铜电极附近观察到黄绿色气体 |
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液的pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
| A.增大反应体系的压强,反应速率可能加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝 |
| D.将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是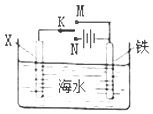
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |