利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
| A.电解时以纯铜作阳极 |
| B.电解时阴极发生氧化反应 |
| C.粗铜连接电源负极,其电极反应是Cu-2e- = Cu2+ |
| D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=6.0 molL-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,求(无相应计算过程不得分)
(1)原溶液中K+的浓度?
(2)此过程中电子转移总数(用NA表示)?
如图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( )
A.⑤④②①③⑥ B.⑤④③①②⑥ C.②①③④⑤⑥ D.⑤③②④①⑥
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴
石蕊试液,则
①电解池中X极上的电极反应式为 ,
②Y电极上的电极反应式为 ,在Y极附近观察到的现象是 。
③电解总反应方程式为 。
(2)如X是金属铁,要在铁件的表面镀铜防止铁被腐蚀,则
①Y电极的材料是 ,电极反应式是 。电解液a选用  溶液。电解过程中其浓度 (增大、减小或不变)
溶液。电解过程中其浓度 (增大、减小或不变)
②若电镀前X、Y两电极的质量相同,电 镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_______mol。
镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_______mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是( )
| A.电源a极为负极 |
| B.KI-淀粉溶液会变蓝 |
| C.可以将惰性电极I换为铜棒 |
| D.惰性电极I上发生的电极反应为:Cu-2e- === Cu2+ |
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是 ( )
在电解水制H2和O2时,为了增强导电性,需加入一些电解质,下列物质可选用:
| A.CuSO4 | B.HC1 | C.NaCl | D.NaOH |
如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
| 组 |
A |
B |
C |
D |
| 甲槽 |
NaOH |
Cu(N O3)2 |
KCl |
Na2SO4 |
| 乙槽 |
CuSO4 |
NaCl |
AgNO3 |
NaNO3 |
溶液中含有两种溶液质—氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是
| A.阴极只析出氢气 | B.阳极先析出氯气后析出氧气 |
| C.电解最后阶段为电解水 | D.电解过程中溶液的PH不断增大,最后pH为7 |
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
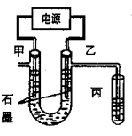
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
如图所示,下列有关装置的分析中正确的是( )

| 选项 |
开关控制 |
X溶液 |
装置叙述 |
| A |
接通K2, 断开K1 |
HCl |
Fe极为正极, 该极质量减小 |
| B |
接通K2, 断开K1 |
CuCl2 |
Fe极为负极, 该极质量增加 |
| C |
接通K1, 断开K2 |
CuSO4 |
Fe极为阴极, 该极有Cu析出 |
| D |
接通K1, 断开K2 |
NaCl |
Fe极为阳极, 该极逐渐溶解 |
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )。
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀 ⑤电泳
| A.①② | B.②③⑤ | C.②③ | D.全部 |
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器。他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置。通电数分钟后,果真制得了消毒液。他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是....…………..( )
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |