下列说法正确的是
| A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
B.向氨水中不断通入CO2,随着CO2的增加, 不断增大 不断增大 |
| C.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0 |
| D.合成氨时,其他条件不变,升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。


请回答:
Ⅰ.用图1、2所示装置进行第一组实验。
(1)A极发生反应的电极反应式为 。
(2)N极发生反应的电极反应式为 。
(3)滤纸上能观察到的现象有 。
(4)标准状况11.2L CH4反应则图2可收集气体 L(标况)
Ⅱ.用图3所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(5)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(6)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和 。
(7)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(8)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为 。
下列说法不正确的是
| A |
B |
C |
D |
| 通电一段时间后, 搅拌均匀,溶液的 pH增大 |
甲电极上的电极反应为: 2Cl--2e-= Cl2↑ |
Pt电极上的电极反应为: O2+2H2O+4e-==4OH- |
总反应的离子方程式 为:2Fe3++Cu=Cu2++ 2Fe2+ |
 |
 |
 |
 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)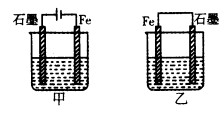
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
| A.正极反应中有CO2生成 |
| B.微生物促进了反应中电子的转移 |
| C.质子通过交换膜从负极区移向正极区 |
| D.电池总反应为C6H12O6+6O2=6CO2+6H2O |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是
| A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 |
| B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-= Fe2+ |
| C.闭合K1断开K2,电流从石墨电极经过K1流向铁电极 |
| D.闭合K1断开K2,左侧烧杯中的溶液pH将逐渐降低 |
关于下列装置的说法正确的是
| A.装置①中盐桥内的K+移向CuSO4溶液 |
| B.装置①将电能转变为化学能 |
| C.若装置②用于铁棒镀铜,则N极为铁棒 |
| D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
有A、B、C、D四种金属,已知:D投入水中可与水剧烈反应;用A和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;B和C的离子共存于电解液中,以石墨为电极电解时阴极析出B。则这四种金属的活动性由强到弱的顺序是
A.C >D> B >A B.B> D > C > A C.D > A > C> B D.D> C> A> B
下图是一个化学过程的示意图。
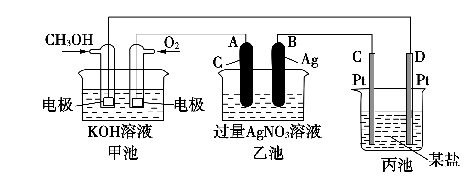
(1)通入O2的电极名称 、C(Pt)电极的名称是______________
(2)写出通入O2的电极上的电极反应式是_______ _______________________。
(3)写出通入CH3OH的电极上的电极反应式是______________________________。
(4)乙池中反应的化学方程式为__________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2__________mL(标准状况下);
对于原电池的电极名称,叙述错误的是( )
| A.发生氧化反应的一极为负极 | B.正极为电子流入的一极 |
| C.比较不活泼的金属为负极 | D.电流流出的一极为正极 |
某学习小组用实验验证牺牲阳极的阴极保护法装置如右图所示,下列说法正确的是: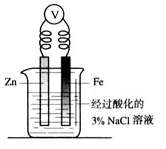
| A.实验过程会观察到电压表指针有偏转,是产生气流所致; |
| B.Zn电极作为负极,发生还原反应; |
| C.向烧杯中滴入铁氰化钾后,铁电极附近出现蓝色沉淀; |
| D.实验过程加入氯化钠是增大电解质溶液的离子浓度以加快反应速率。 |
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:

①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:

①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
下列有关物质的性质和应用对应正确的是( )
| A.炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 |
| B.碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多 |
| C.盐酸与苛性钠可自发进行反应,该反应可以设计成原电池 |
| D.次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 |