用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++eˉ=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
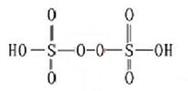
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
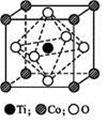
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 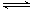 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。
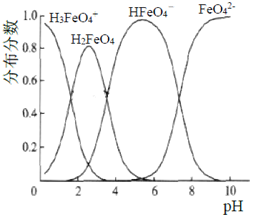
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-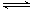 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
I.下图为相互串联的三个装置,试回答: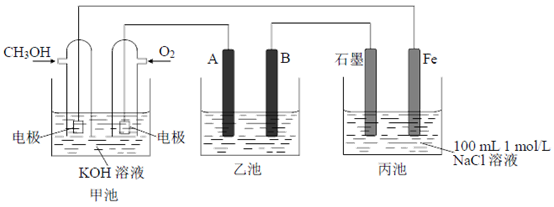
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
碱性锌锰电池比普通锌锰电池性能好 |
锌在碱性介质中被氧化成更高价态 |
| B |
配制FeCl2溶液时加入少量铁粉 |
抑制Fe2+的水解 |
| C |
施肥时,草木灰(有效成分为K2CO3)不能与铵盐氮肥混合使用 |
它们反应生成氨气会降低肥效 |
| D |
纯水和干木头都不导电,但木头用水浸湿后却可以导电 |
水和干木头的某些成分发生化学反应 |
(1)工业上常用 CO2和 NH3通过如下反应合成尿素[CO(NH2)2]。
2NH3(g)+CO2(g)  CO(NH2)2(g)+H2O(g) △H<0
CO(NH2)2(g)+H2O(g) △H<0
t℃时,向容积恒定为 2L的密闭容器中加入 0.10 molCO2和 0.40 molNH3, 70 min 开始达到平衡。反应中 CO2 (g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①70 min 时,平均反应速率 υ(CO2)= mol/(L·min)。
②在100 min时,保持其它条件不变,再向容器中充入0.050 mo1CO2和0.20 molNH3, 重新建立平衡后CO2的转化率与原平衡相比将___________(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_________(保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液 制取氢气。该装置中阳极的电极反应式为__________________。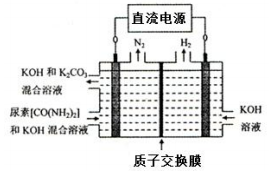
(2)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。
持续通入甲烷,在标准状况下,消耗甲烷体积VL。当0<V≤44.8 L 时,电池总反应方程式为______________。
在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是
| A.外电路的电流方向为:X→外电路→Y |
| B.X极上发生的是还原反应 |
| C.溶液中氢离子向X极移动 |
| D.若两电极都是金属,则它们的活动性顺序为X>Y |
铜锌原电池(如图)工作时,下列叙述正确的是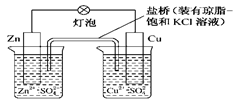
| A.正极反应为Zn-2e-===Zn2+ |
| B.电池反应为Zn+Cu2+===Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
铜锌原电池(如图)工作时,以下说法正确的是 ( )
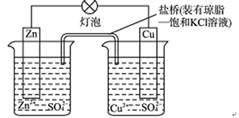
①电子流动方向从Zn—灯泡—Cu—盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+=Zn2++Cu;⑤Zn电极失电子发生还原反应
| A.①②③ | B.②④⑤ | C.②③④ | D.③④⑤ |
人造地球卫星用到的一种高能电池――银锌蓄电池,其电池的电极反应式为
Zn + 2OH- - 2e- =" ZnO" + H2↑,Ag2O + H2O + 2e- =" 2Ag+" 2OH-。据此判断氧化银是( )
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
有关下列电化学装置的说法中正确的是( )

| A.图a是原电池装置,可以实现化学能转化为电能 |
| B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
(I)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。该电池工作时的正极反应式为: ;
(II)某课外活动小组用如图装置进行实验,试回答下列问题:
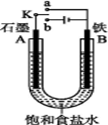
(1)若开始时开关K与a连接,则B极的电极反应为 。 向B极附近滴加铁氰化钾溶液现象是 发生反应的离子方程式
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。习惯上把该工业生产称为
(3)有关上述实验,下列说法正确的是 。
| A.溶液中Na+向A极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 |
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)____________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___________________