(每空2分,共10分)依据事实,填空:
(1)已知某条件下可发生如下反应CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
则该反应的热化学方程式右边的ΔH= ;
(2)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极: ;负极:
(3)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;
(4) 将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。此过程的总反应方程式为 。
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
下图是元素周期表的框架
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
| A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示)。 |
| B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是(用化学式表示)。 |
| C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写结构式)。 |
| D.在上面元素周期表中全部是金属元素的主族是;全部是非金属元素的主族是(填写字母a、b、c、d)。 |
a.ⅠA族 b. ⅡA族 c. ⅥA 族 d.ⅦA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;
(4)请写出仅用①②④三种元素形成离子化合物的电子式_________。若用球棍模型表示①和③形成的化合物的分子结构,应该是 。
⑸ 在120℃下1g①的单质在足量③的单质中完全燃烧,放出的热量为a kJ;请写出此条件下①的单质燃烧的热化学方程式 ;
①、③两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
请回答:b是电池的 极;a电极上的电极反应式是 。
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电子从________极流向________极(填“Ag2O”或“Zn”)。其用到的电解质溶液是 (填“KOH ”或"H2SO4")
②电极反应式:正极____________________________________________,
③工作时电池电解质溶液pH________(填“增大”、“减小”或“不变”)。
(2) 2009年10月,中国科学院长春应用化学研究所在甲醇(CH3OH一种可燃物)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如右图所示。
①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
②该电池正极的电极反应式___________
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式_____ ________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);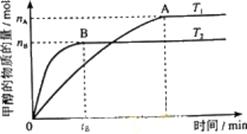
①温度升高该反应的平衡常数 (增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是 mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为 。
(1)钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是 (填电极材料),正极发生的是 反应(填反应类型),
总反应式为 。
(2)图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。试回答下列问题:
①图中通过负载的电子流动方向______ (填“向左”或“向右”).
②写出氢氧燃料电池工作时正极反应方程式 :
③放电过程中,负极附近溶液的pH (填“增大”,“减小”,“保持不变”)
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为 。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应式 。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
将锌片和铜片用导线相连后一同插入稀硫酸中,导线上便有电流通过。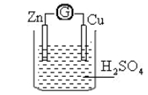
(1)锌片为___ ___(填“正极”或“负极”),电极反应是 。
(2)铜片为__________(填“正极”或“负极”),发生 反应(填“ 氧化”或“还原”)。
氧化”或“还原”)。
(3)该原电池工作时,溶液中的SO42-向 极移动,铜极上的现象是 。
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成 原电池的是 。
原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此 装置电解精炼铜, 做阳极,电解液CuSO4的浓度
装置电解精炼铜, 做阳极,电解液CuSO4的浓度  (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______________。要清洗附着在试管壁上的硫,可用的试剂是________。
(2)如图所示为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,负极的电极反应式为________,正极的电极反应式为________。M(由Na2O和Al2O3制得)的两个作用是________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。(Pb的相对原子质量为 207)
(3)Na2S溶液水解的化学方程式 。溶液中离子浓度由大到小的顺序为_______,向该溶液中加入少量固体CuSO4,溶液pH________(填“增大”“减小”或“不变”)。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+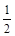 O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+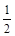 O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
⑴反应Ⅰ的焓变△H1= 。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4= 。
与CO和H2相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是 。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下: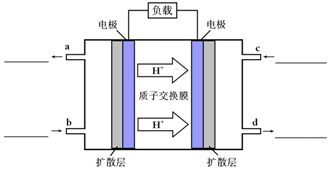
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化 学式)
学式)
②负极的电极反应式为 。
(14分)近年来,我闽许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列做法中,有利于降低大气中的 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。
a. 直接用煤做燃料
b. 开私家车
c. 棺树造林以增加绿化面积
d. 研究、幵发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知: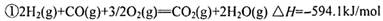
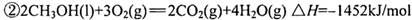
请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:__________
(3) 利用电化学原理将CO、SO2R化为重要化工原料,装置如图所示: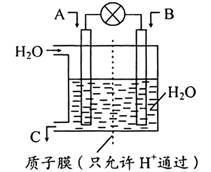
①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_____极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:__________
(4) ①已知:密闭容器中,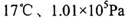 条件下,
条件下,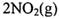
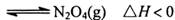 ,其平衡常数K=13.3。
,其平衡常数K=13.3。
当此反应达到平衡时,若 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体屮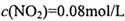 ,
, ,则改变的条件是____________________
,则改变的条件是____________________
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
则阴极的电极反应式为____________________________________________________。
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料。
(1)CH4可与Cl2反应,其反应机理如下:
(2)Cl2→2Cl2 △H=" +243" kJ·mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:________
(2)在一定条件下,发生反应:CH4(g)+H2O(g) ClO(g)+3H2(g)△H>0。
ClO(g)+3H2(g)△H>0。
在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”)。若在2L密闭容器中发生反应,T℃时,通入2 mol CH4(g)和2 mol H2O(g),反应达平衡后,生成l mol CO,此时向容器中同时加入1mol CO和3 molH2的混合气体(保持温度不变),则平衡将 _______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数_______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g) CH3OH(g)△H=—90.1kJ·mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有________(选填序号)。
CH3OH(g)△H=—90.1kJ·mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有________(选填序号)。
a.再充入1 mol H2 b.使用健化剂 c.再充入2 mol CO d.升高温度
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:则正极的电极反应式为________;反应一段时间后溶液的pH________(填“升高”、“降低”
或“不变”)。