将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2) 若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| ① |
Mg 、Al |
稀盐酸 |
偏向Al |
| ② |
Al、Cu |
稀盐酸 |
偏向Cu |
| ③ |
Al、石墨 |
稀盐酸 |
偏向石墨 |
| ④ |
Mg、Al |
NaOH溶液 |
偏向Mg |
| ⑤ |
Al、Zn |
浓硝酸 |
偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验①、②中Al所作的电极是否相同?
答:____________________________________________
(2)写出实验③中的电极名称、电极反应式和电池总反应方程式。铝为( )______________________________
石墨为( )__________________________
电池总反应:__________________________
(3)实验④中的铝作________极。
(4)实验⑤中铝作________极。
(1)Zn∣H2SO4溶液∣C原电池:负极反应 
正极反应 ;电池反应
(2)H2∣KOH溶液∣O2原电池:负极反应
正极反应 ;电池反应
(8分)分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是______。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式________________。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
①电极X的材料是  ;电解质溶液Y是 ;
;电解质溶液Y是 ;
②银电极为电池的 极,发生 的电极反应式为 ;X电极上发生的电极反应式为 ;
的电极反应式为 ;X电极上发生的电极反应式为 ;
③外电路中的电子是从 电极流向 电极。
(2)物质Z是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
①若Z为氧化物,X的化学式是___________________________。
②若Z为单质,Z与NaOH溶液反应的离子方程式为___________________________________。
③若Z与稀硫酸反应生成无色没有气味的气体A,与氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
Z与稀硫酸反应的离子方程式是______________________________________;
Z与足量氢氧化钠溶液加热的离子方程式是__________________________。
请按要求回答下列问题。

(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
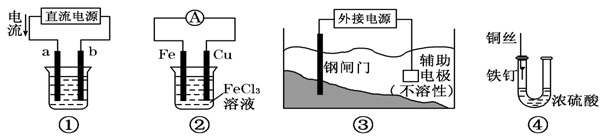
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。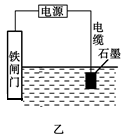
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。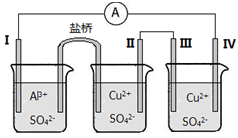
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________________。
(2)工作时,正极反应为______________________。
(3)工作时,电解质溶液的酸性________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向________极。(填“正”或者“负”)
(5)电流方向从________极流向________极。(填“正”或者“负”)
(1)下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为 。
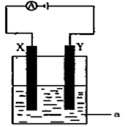
将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
| 金属 |
电子流动方向 |
电压/V |
| Fe |
Fe → Cu |
+0.78 |
| Zn |
Zn → Cu |
+1.10 |
| A |
Cu → A |
-0.15 |
| B |
B → Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 (填“大”、“小” )。Zn、A、B三种金属活动性由强到弱的顺序是 。
(2)Cu与A组成的原电池, 为负极,此电极反应式为 。
(3)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。