将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
(1)铁片上的电极反应式为 ,铜片上的电极反应式为 ,铜片周围溶液会出现 的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为 mo1,该段时间内用硫酸铜表示的平均反应速率为 。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是 mo1/min。(以上均假设反应过程中溶液体积不变)。
从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
2FeCl3+Cu=2FeCl2+CuCl2
负极为 ,电极反应方程式为 ,
正极应选 ,电极反应方程式为 。
甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成 (化学式)
,如果他的铁片更换,你认为可以换成 (化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极: 正极:
有铜片、锌片和250mL稀硫酸组成的原电池,当在铜片上放出4.48L(标准状况下)的气体时,硫酸恰好完全反应。
(1)该原电池的负极反应式
(2) 原稀硫酸的物质的量浓度是 mol/ L
(3)锌片减少的质量
将铝片和镁片用导线连接插入氢氧化钠电解质溶液中,写出该装置中负极的电极反应式和总反应的离子方程式。
(1) 负极反应式 总反应离子方程式
(6分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: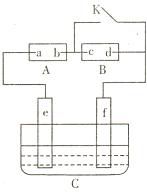
(1)电源A的a为 极(1分);
(2)滤纸B上发生的总化学方程式为: (2分)
(3)欲在电镀槽中实现铁上镀锌,接通K点,则电极e上发生的反应为: (2分)[槽中盛放的电镀液可以是 (1分)。
(6分)在由铜片、锌片和150 mL稀硫酸组成的原电池中,当在铜片上放出6.72 L(标准状况)的H2时,硫酸恰好用完,则:
(1) 产生这些气体消耗的锌的质量是 g;
(2) 通过导线的电子的物质的量是 mol;
(3) 该原电池正极的电极反应式为 。
(6分)将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
(2)装置乙中,总反应的离子方程式为 ;若导线上通过0.2 mol电子,消耗锌的质量为 g。
由铜、锌和稀硫酸组成的原电 池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从 极到 极;电流方向是从
池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从 极到 极;电流方向是从 极到 极。
极到 极。
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。
在b电极上发生的反应可表示为:PbO2+4H++SO +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反
素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 应的离子方程式为____________________________________。
应的离子方程式为____________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池A: , B:______(填“能”与“不能”)
如果不能,说明其原因
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是 , 正极材料是_______,电解质溶液是 ;
②写出正极的电极反应式 ,正极发生 反应(填“氧化”或“还原”),
③若导线上转移电子0.1mol,则负极质量变化 克。
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1) 电解质溶液为稀H2SO4时,灯泡____(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:_________________________________.
(2) 电解质溶液为NaOH(aq)时,灯泡____(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:________________________.
我国首创的以铝、空气、海水为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧气使铝不断氧化而产生电能,其正极电极反应式为:
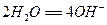 ,负极电极反应式为:
,负极电极反应式为: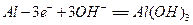 ,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
(1)此种新型电池的负极材料是
(2)电池总反应式为
(1)今有氢氧燃料电池,则正极通入的气体是________,负极通入的气体是________,电解质溶液为稀硫酸时,电极反应式为:正极__________ ____负极______ ______ ____,电池的总反应式为
(2)如把H2改为甲烷、KOH作导电物质,则电极反应式为:负极_________ _______