甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题: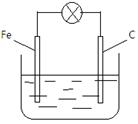
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成 (化学式)
,如果他的铁片更换,你认为可以换成 (化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极: 正极:
甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成 (化学式)
,如果他的铁片更换,你认为可以换成 (化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极: 正极: