某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,SO42-向铜电极移动 |
某原电池总反应离子方程式为:2Fe3+ +Fe == 3 Fe2+,能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 |
| B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
有关电化学知识的描述正确的是
| A.CaO+H2O===Ca(OH)2ΔH<0,故可把该反应设计成原电池 |
| B.某原电池反应为Cu+2AgNO3==Cu(NO3)2+2Ag,装置盐桥中为装有含琼胶的KCl饱和 溶液 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
下列关于原电池的叙述中,正确的是 ( )
| A.构成原电池的两极必须是两种不同的金属 |
| B.原电池中发生的反应一定是氧化还原反应 |
| C.原电池工作时总是负极溶解,正极上有物质析出 |
| D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原、 |
两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是
| A.A的金属性强于B | B.电子不断由A电极经外电路流向B电极 |
| C.A电极上发生的电极反应是还原反应 | D.A的金属活动性一定排在氢前面 |
有关下图的说法正确的是
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
下图为水果电池的示意图,下列说法正确的是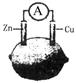
| A.锌片作负极,质量逐渐减少 | B.电子由铜片沿导线流向锌片 |
| C.铜电极逐渐溶解 | D.该装置能将电能转化为化学能 |
下列说法正确的是
| A.流水、风力是一次能源,电力、蒸汽是二次能源 |
| B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C.铅蓄电池是一次电池,氢氧燃料电池是二次电池 |
| D.同周期元素形成的简单离子中,原子序数越大的离子半径越小 |