下列各组材料中,不能组成原电池的是:
| |
A |
B |
C |
D |
| 两极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
| 插入溶液 |
稀硫酸 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
下列关于右图所示原电池装置的叙述中,正确的是( )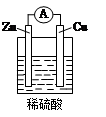
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
某原电池的总反应是Zn+Cu2+= Zn2+ + Cu,该原电池的正确组成是( )
A B C D
正极 Zn Cu Zn Cu
负极 Cu Zn Cu Zn
电解质溶液 CuCl2 CuCl2 ZnCl2 ZnCl2
下列关于原电池的叙述中错误的是( )
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转变为电能的装置 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.原电池放电时,电流的方向是从正极到负极 |
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为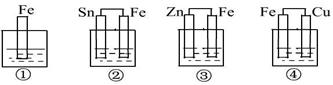
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,SO42-向铜电极移动 |
下列反应中不可能设计成原电池的是( )
| A.NaOH+HCl===NaCl+H2O | B.2Fe3++Fe===3Fe2+ |
| C.Zn+2HCl===ZnCl2+H2↑ | D.4Al+3O2+6H2O===4Al(OH)3↓ |
右图为一原电池装置,其中X、Y为两电极。对此装置的下列说法中正确的是( )
| A.若两电极都是金属,则它们的活动性顺序为:X>Y |
| B.外电路的电流方向是:X→外电路→Y |
| C.若两电极分别为锌棒和石墨棒,则X为石墨 |
| D.Y极上发生的是氧化反应 |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,
0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| |
实验步骤 |
实验现象及相关结论 |
| ① |
取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ② |
继续加入 溶液,再加入 溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4。 |
| ③ |
另取少量电解质溶液于试管中,先加 1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡。 |
; 。 |
(5)若电池开始工作时每100mL电解质溶液含KOH56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度 。 (结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.钢铁在海水中发生电化腐蚀时,铁是负极被氧化 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
原电池是将化学能直接转化为电能的装置,原电池反应的本质是
| A.化合价的升降 | B.离子定向移动 |
| C.氧化还原反应 | D.电能的储存 |