有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯 中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
| B.电解质溶液中混入碱溶液,对电池反应无影响 |
| C.电池的正极为:Li-e-====Li+ |
| D.电池工作过程中,亚硫酰氯(SOCl2)仅被还原为Li2SO3 |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
【改编】下列离子方程式正确的是
| A.将铁和铜用导线连接后同时插入硝酸银溶液中,铜上的电极反应为:Cu-2e-=Cu2+ |
| B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+= 2Fe3++2Cl- |
| C.将金属钠放入硫酸铜溶液中:2Na+Cu2+-=2Na++Cu |
| D.酸性氢氧燃料电池的正极反应:H2-2e-= 2H+ |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO |
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
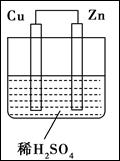

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42―–2e―=PbSO4 ①
PbO2+4H++SO42―+2e―=PbSO4+2H2O ②
下列有关铅蓄电池的说法不正确的是:
| A.①式表示负极反应,②式表示正极反应 |
| B.铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 |
| C.铅蓄电池在放电时,电子从Pb通过导线流向PbO2 |
| D.铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的
| A.放电时负极反应为:Zn+2OH-→Zn(OH)2+2e- |
| B.充电时阳极反应为:Fe(OH)3+5OH-→FeO42-+4H2O+3e- |
| C.放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-=LiFePO4 负极 Li-e-= Li+ 下列说法中正确的是
| A.充电时电池反应为FePO4+Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的正极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子发生氧化反应 |
将铁片和碳棒按下图所示方式插入硫酸铜溶液中,电流计指针发生偏转。下列针对该装罝的说法,正确的是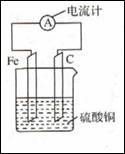
| A.碳棒是正极 |
| B.该装置能将电能转化为化学能 |
| C.外电路中电流由铁片流出经过电流计流向碳棒 |
| D.该装置的总反应为:2Fe+3Cu2+=2Fe3++3Cu |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: ,下列叙述错误的是:
,下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 | B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 | D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
关于甲、乙装置的下列叙述中正确的是
| A.甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动 |
| B.C电极的电极反应为:O2+4e-+4H+==2H2O |
C.乙池中的总反应为:Cu+H2SO4 H2 H2 +CuSO4 +CuSO4 |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是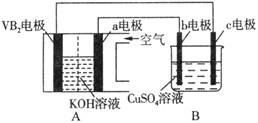
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
观察下列几个装置示意图,有关叙述正确的是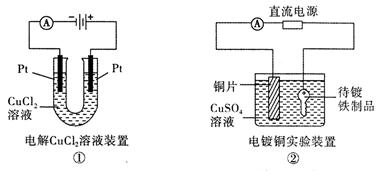
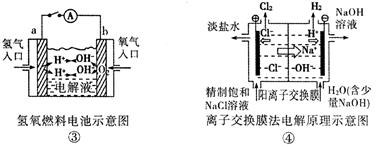
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
根据下图实验装置判断,下列说法正确的是
| A.该装置能将电能转化为化学能 |
| B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑ |
| C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3 |