气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 |
部分电极反应产物 |
| NO2 |
NO |
| Cl2 |
HCl |
| CO |
CO2 |
| H2S |
H2SO4 |
A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl-
对下图装置的叙述错误的是
| A.X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应。 |
| B.X如果是CuSO4,a和b分别连接直流电源正、 负极,一段时间后铁片质量增加。 |
| C.X如果是HCl,则不论a和b用导线连接还是 a和b分别连接直流电源的正、负极时,H+的移动方向均相同。 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程。 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
一种新型燃料电池,一极通入空气,另一极通入甲烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.在外电路,电流从甲烷所通电极流向空气所通电极 |
| C.通入空气的一极是正极,电极反应为:O2-4e-=2O2- |
| D.通入甲烷的一极是负极,电极反应为: CH4-8e-+4O2-=CO2+2H2O |
利用下图所示联合装置制备金属钛,下列叙述正确的是
| A.甲装置中通入O2的电极反应式为:O2+4 e-= 2O2- |
| B.若不考虑能量的损失,制备24.0g金属钛,需要消耗氢气22.4 L |
| C.甲装置工作过程中pH减小 |
| D.乙装置中的石墨电极反应式为:C+2O2--4e-=CO2↑ |
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示。若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,下列有关说法正确的是
| A.外接负载时,左槽作为原电池负极,发生氧化反应 |
| B.外接电源时,左槽连接外接电源的正极,发生还原反应 |
| C.负载是镀铜的电镀槽时,H+由左槽向右槽移动 |
| D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是
| A.总反应方程式式都为CH4+2O2===CO2+2H2O |
| B.H2SO4和NaOH的物质的量都不变,但浓度都减小 |
| C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+ |
| D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH- |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
利用如图装置进行实验,甲乙两池均为1 mol•L—1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓度差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO3— 向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2(SO4)3 |
| D. |
CuSO4 |
AgNO3 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一小段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗560 mL(标准状况下)O2,此时丙池中理论上最多产生2.9g固体 |
【改编】如图所示的电化学装置,下列叙述正确的是
| A.a和b用导线连接,溶液中的Na+向铁电极移动 |
| B.a和b用导线连接,碳电极的电极反应为:O2+2H2O-4e-=4OH— |
| C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀,属于牺牲阳极的阴极保护法 |
| D.若碳电极换成铜电极,氯化钠换成硫酸铜,a、b分别连接直流电源负、正极,可实现铁上镀铜 |
某心脏起搏器的动力来源于Li-SOCl2电池。该电池的总反应可表示为:
4Li+2SOCl2 =" 4LiCl" +S +SO2。下列关于该电池的说法正确的是( )
| A.放电过程中Li+向负极移动 |
| B.该电池的电解质溶液为NaCl水溶液 |
| C.正极电极反应式为: 2SOCl2+4e-= 4Cl— +S +SO2 |
| D.当0.4mol Li完全溶解时,流经电解质溶液的电子个数为2.408×1023 |
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是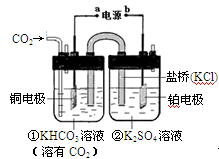
| A.该过程是电能转化为化学能的过程 |
| B.铜电极的电极反应式为:CO2+8H++8e-=CH4+2H2O |
| C.一段时间后,①池中n(KHCO3)不变 |
| D.一段时间后,②池中溶液的pH一定下降 |
将反应IO3- + 5I- + 6H+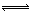 3I2 +3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
3I2 +3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是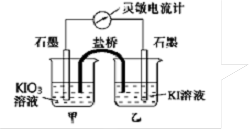
| A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.两次电流计指针偏转方向相反 |