将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是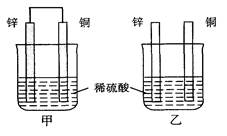
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均减小 |
| D.产生气泡的速度甲比乙快 |
下列关于电化学的说法中错误的是
| A.原电池的负极、电解池的阳极均发生氧化反应 |
| B.原电池将化学能转化为电能,电解池将电能转化为化学能 |
| C.电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 |
| D.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是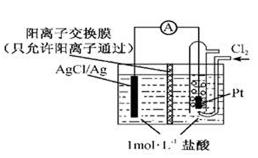
| A.正极反应为AgCl+e-=Ag+Cl- |
| B.放电时,交换膜左侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.01mol离子 |
碳纳米管是近年来材料科学研究的热点。为除去碳纳米管中的杂质——碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体。以下判断正确的是
| A.可以用浓盐酸调节K2Cr2O7溶液的酸性 |
| B.该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
| C.若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
| D.可以通过过滤的方法最终得到碳纳米管 |
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反为:FePO4+Li=====LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量增加 |
| D.放电时电池正极反应为:FePO4+Li++e-==LiFePO4 |
电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O + H2O + Zn = Zn(OH)2 + 2Ag。下列叙述正确的是
| A.Zn是正极, Ag2O是负极 |
| B.Zn是负极,Ag2O是正极 |
| C.该电池可将化学能100%转化为电能 |
| D.工作时电子由Zn极经溶液移向Ag2O极 |
下列说法中正确的是
| A.原电池放电过程中,负极质量一定减轻,或正极的质量一定增加 |
| B.Fe、Cu组成原电池,Fe一定是负极 |
| C.为加快一定量的Zn与足量稀H2SO4反应的速率,且不影响生成H2总量,可加入少量CuSO4溶液 |
| D.某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式:Ag-e-+Cl-=AgCl |
某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是
| A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.b电极上发生还原反应 |
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=H2↑ |
| B.断开K1,闭合K2时,OH-向b极移动 |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| D.断开K2,闭合K1,一段时间后溶液的pH值要变大 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
下列用来表示物质变化的化学用语中,错误的是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| B.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2+ +2e- =Cu |
C.用Pt电极电解氯化铝溶液:2Cl-+2 H2O  Cl2↑+H2+2OH- Cl2↑+H2+2OH- |
| D.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是
| A.产生气体体积①=② |
| B.电极上析出固体质量①<② |
| C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑ |
| D.溶液的pH变化:①减小②增大 |
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是
| |
M |
N |
P |
| A、 |
锌 |
铜 |
 稀硫酸溶液 稀硫酸溶液 |
| B、 |
铜 |
铁 |
稀盐酸 |
| C、 |
银 |
锌 |
 硝酸银溶液 硝酸银溶液 |
| D、 |
铜 |
铁 |
硝酸铁溶液 |
如图为锌铜显示原电池装置图,下列说法不正确
| A.电子由Zn极流向Cu极 |
B.该装置的总反应 |
| C.一段时间后,A池带正电荷,B池带负电荷 |
| D.取出盐桥,电流计指针不再偏转 |