近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu20+H2O=2Cu+2Li++20H-,下列说法不正确的是
| A.放电时,Li+透过固体电解质向Cu极移动 |
| B.放电时,负极的电极反应式为 Cu2O+H2O+2e-=Cu+2OH- |
| C.通空气时,铜被腐蚀,表面产生Cu20 |
| D.整个反应过程中,铜相当于催化剂 |
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )

| A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.b电极上发生还原反应 |
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是
| A.电子经外电路流向Pt电极 |
| B.电池工作时,电解质中Ag+数目减少 |
| C.正极反应:Cl2+2e—+2Ag+ = 2AgCl |
| D.空气中c(Cl2)越大,Ag极消耗速率越快 |
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活动性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
普通锌锰干电池的简图(下图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽。在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是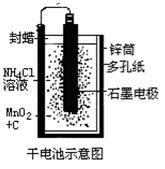
| A.当该电池电压逐渐下降后,利用电解原理能重新充电复原 |
| B.电池负极的电极反应式为:2MnO2+2NH4++2e- = Mn2O3+2NH3+H2O |
| C.该电池碳棒可用铜棒代替,但是工作电压会下降 |
| D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是

| A.甲中铜片作阴极,K+向铜片电极移动 |
B.乙中正极发生的电极反应为CO2+6e-+6H+ CH3OH+H2O CH3OH+H2O |
| C.乙中H2SO4的作用是增强溶液的导电性 |
| D.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 |
某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是
| A.K与M、N均断开,一段时间后电解质溶液质量变大 |
| B.K分别与M、N相连时,铁均受到保护 |
| C.K与M相连时,每转移1mol电子Fe表面生成32gCu |
| D.K与N相连时, 碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体 |
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=H2↑ |
| B.断开K1,闭合K2时,OH-向b极移动 |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| D.断开K2,闭合K1,一段时间后溶液的pH值要变大 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
下列用来表示物质变化的化学用语中,错误的是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| B.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2+ +2e- =Cu |
C.用Pt电极电解氯化铝溶液:2Cl-+2 H2O  Cl2↑+H2+2OH- Cl2↑+H2+2OH- |
| D.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是
| A.产生气体体积①=② |
| B.电极上析出固体质量①<② |
| C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑ |
| D.溶液的pH变化:①减小②增大 |
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是
| |
M |
N |
P |
| A、 |
锌 |
铜 |
 稀硫酸溶液 稀硫酸溶液 |
| B、 |
铜 |
铁 |
稀盐酸 |
| C、 |
银 |
锌 |
 硝酸银溶液 硝酸银溶液 |
| D、 |
铜 |
铁 |
硝酸铁溶液 |
如图为锌铜显示原电池装置图,下列说法不正确
| A.电子由Zn极流向Cu极 |
B.该装置的总反应 |
| C.一段时间后,A池带正电荷,B池带负电荷 |
| D.取出盐桥,电流计指针不再偏转 |