如图所示,在不同的电解质溶液中可以组成不同的电池。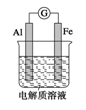
(1)①当电解质溶液为稀硫酸时,Fe电极是_____ (填“正”或“负”)极.其电极反应式为______
②当电解质溶液为NaOH溶液时,Al电极是____(填“正”或“负”)极.其电极反应式为______
(2)若把铝改为钢.电解质溶液为浓硝酸,则Fe 电极是_____(填“正”或“负”)极.其电极反应式为______。
某原电池装置如图所示,电池总反应为2Ag + Cl2="2" AgCl。下列说法正确的是
| A.正极反应AgCl +e- = Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
根据下图,可判断出下列离子方程式中错误的是
| A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s) |
| B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq) |
| C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq) |
| D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq) |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中溶液的酸性均减弱 |
| B.产生气泡的速度甲比乙快 |
| C.两烧杯中铜片表面均无气泡产生 |
| D.甲中铜片是正极,乙中铜片是负极 |
结合图判断,下列叙述正确的是
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
依据氧化还原反应:Zn(s) + Cu2+(aq) ="=" Zn2+(aq)+ Cu(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是_________ ;电解质溶液Y是_________ ;
(2)铜电极为电池的________极,发生的电极反应为____________ ____ ;X电极上发生的电极反应为______________________。
在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是
| A.锌片是正极,铜片上有气泡产生 |
| B.溶液中H2SO4的物质的量减少 |
| C.电流方向是从锌片流向铜片 |
| D.电解液的pH保持不变 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
| A.a>b>c>d | B.c>a>b>d | C.a>c>d>b | D.b>d>c>a |
关于右图所示的原电池,下列说法不正确的是
| A.铜片为正极,锌片为负极 |
| B.锌片溶解,质量减少 |
| C.该装置将化学能转化为电能 |
| D.电子由铜片经导线流向锌片 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
某学生欲实现Cu + H2SO4= CuSO4 + H2↑反应,设计了四个实验,如图所示,你认为可行的实验是
下列有关说法正确的是
| A.S(s,单斜)═S(s,正交) ΔH= +0.33kJ•mol‑1,正交硫比单斜硫稳定 |
| B.2H2(g)+O2(g)═2H2O(g); ΔH=﹣489.6kJ•mol-1,氢气的燃烧热为489.6kJ•mol-1 |
| C.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起到保护作用 |
| D.锌锰干电池工作一段时间后碳棒变细 |
下列装置烧杯申盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
如图所示,利用2Ag + Cl2 = 2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质)。下列分析不正确的是
| A.空气中c(Cl2)越大,Ag极消耗速率越快 |
| B.Ag+向Pt电极移动 |
| C.电子由Ag电极经外电路流向Pt电极 |
| D.Ag电极上发生了还原反应 |
Ⅰ.现有反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;
CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;
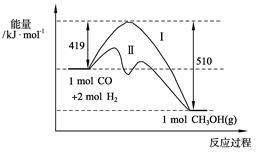
已知该反应中相关的化学键键能数据如下:
| 化学键 |
H—H |
C—O |
H—O |
C—H |
| E/(kJ·mol-1) |
436 |
343 |
465 |
413 |
则C≡O中的键能为 KJ·mol-1;图中曲线Ⅱ表示 (填反应条件)的能量变化。
Ⅱ. Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 ="4LiCl+S" +SO2。
请回答下列问题:
(1)电池的负极发生的电极反应为 ;
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式 ;