某原电池的结构如右图所示,下列有关该原电池的说法不正确的是
| A.该电池工作时电能转变为化学能 |
| B.铁片的质量变轻 |
| C.铜片上发生的反应2H++2e-= H2↑ |
| D.SO42-向铁片移动 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
有关如下图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是
| A.铜棒上有气泡逸出 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.反应前后铜棒质量不改变 |
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH﹣﹣2e﹣=ZnO+H2O;Ag2O+H2O+2e﹣=2Ag+2OH﹣
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag20极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是
| A.A接电源负极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H2 6.72 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
关于铅蓄电池的说法正确的是( )
| A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是
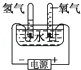
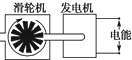


| A.电解水 | B.水力发电 | C.太阳能热水器 | D.干电池 |
某同学组装了如图所示的原电池装置,下列叙述中正确的是
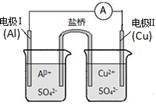
A.电流方向:电极Ⅱ→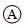 →电极Ⅰ →电极Ⅰ |
| B.电极Ⅱ逐渐溶解 |
| C.电极Ⅰ上发生还原反应 |
| D.盐桥中装有含氯化钾的琼脂,Cl¯向右池移动 |
有关电化学知识的描述正确的是
| A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
| B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
| C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+ |
| D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-===Mg(OH)2 |
铜锌原电池(如图)工作时,下列叙述正确的是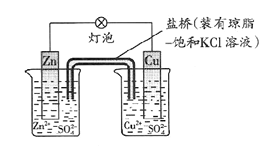
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是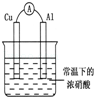
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
某学习小组依据反应:SO2(g)+ Cl2(g)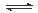 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
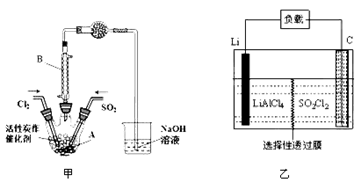
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。