如图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( )
A.⑤④②①③⑥ B.⑤④③①②⑥ C.②①③④⑤⑥ D.⑤③②④①⑥
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )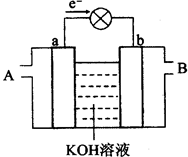
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
原电池产生电流的本质原因是 ( )
| A.原电池中溶液能电离出自由移动的离子 |
| B.有导线将两个活动性不同的电极连接 |
| C.正极发生了氧化反应,负极发生了还原反应 |
| D.电极上进行的氧化还原反应中有电子的转移 |
下列说法中正确的是
| A.原电池是把电能转变为化学能的装置 |
| B.原电池中电子流出的一极是负极,发生氧化反应 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子向负极方向移动 |
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为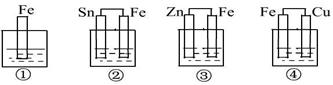
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
有关下图的说法正确的是
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
原电池是将化学能直接转化为电能的装置,原电池反应的本质是
| A.化合价的升降 | B.离子定向移动 |
| C.氧化还原反应 | D.电能的储存 |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.上图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
| A.电流由O2所在的铂电极流出 |
| B.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+ |
| C.O2所在的铂电极处发生还原反应 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
下列说法正确的是
| A.流水、风力是一次能源,电力、蒸汽是二次能源 |
| B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C.铅蓄电池是一次电池,氢氧燃料电池是二次电池 |
| D.同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是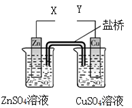
| A.X和Y与电流表连接,电子由Cu极流向Zn极 |
| B.X和Y与电流表连接,将Zn换成Fe测得电流更大 |
| C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻 |
| D.X和Y分别与电源“—”、“+”极相连,Zn极质量减轻 |